
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出_______kJ热量。
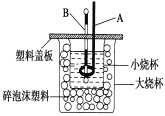
(2)如图装置中仪器A的名称是____________,碎泡沫塑料的作用是_____________________________;要重复进行三次实验的目的是 ____________________。
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填“偏大”、“偏小”、“无影响”)。
(4)将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是_____。
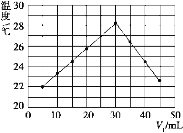
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
【答案】11.46 环形玻璃搅拌棒 保温隔热 提高实验准确性 偏小 B
【解析】
(1)根据中和热的含义:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,所以0.1 mol Ba(OH)2稀溶液与足量稀硝酸反应时生成0.2 mol H2O(l),据此计算出反应放出的热量;
(2)根据仪器的用途进行分析;在测定中和热的实验中,减少热量损失是实验的关键,据此分析碎泡沫塑料的作用;做定量实验,为了提高实验准确性,减小误差,要重复进行实验;
(3)氨水代替NaOH(aq),会使测得的中和热数值偏小,因为氨水(NH3·H2O)是弱电解质,电离时需吸收热量;
(4)用A实验时的温度应为酸碱未混合之前的温度;
B.根据图示所测溶液温度变化进行分析;
C.根据氢氧化钠溶液与盐酸溶液反应方程式进行计算;
D.生成水的反应不一定为放热反应。
(1)根据中和热的含义:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,所以0.1 mol Ba(OH)2稀溶液与足量稀硝酸反应时生成0.2 mol H2O(l),故放出的热量为11. 46 kJ;
故答案是: 11.46;
(2)由实验装置知,A为环形玻璃搅拌棒,作用是搅拌,使溶液充分混合;碎泡沫塑料的作用是减少实验过程中的热量损失;要重复进行三次实验的目的是:提高实验准确性,减少实验误差;
故答案是:环形玻璃搅拌棒;保温隔热;提高实验准确性;
(3)用氨水代替NaOH(aq),会使测得的中和热数值偏小,因为氨水(NH3·H2O)是弱电解质,电离时需吸收热量;
故答案是:偏小;
(4)A.温度为22 ℃时加入盐酸10mL,则不是实验时环境温度,故A错误;
B.由图示可以看出该反应过程放出热量,表明化学能转化为热能,故B正确;
C.恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50 mL可以知道,消耗的氢氧化钠溶液的体积为20mL;根据反应HCl+NaOH=NaCl+H2O可知:n(HCl)=n(NaOH) ,则 1.00 mol/L×0.03L=c×0.02L,c =1.5mol/L;故C错误;
D.只是该反应为放热反应,其它有水生成的反应不一定是放热反应,如氯化铵和氢氧化钡晶体的反应,为吸热反应,故D错误;
故答案选B。


科目:高中化学 来源: 题型:
【题目】钛及其化合物应用广泛。
(1)(钛元素基态原子核外最外层电子的自旋状态___(填“相同”或“相反”)。
(2)已知一定条件下TiO2与TiCl4之间可以相互转化:TiO2![]() TiCl4。
TiCl4。
①Ti、Cl、O三种元素电负性由大到小的顺序为___。
②COCl2的分子构型为___,键角大小比较∠Cl—C—O___∠C1—C—Cl(填“>”或“<”),σ键和π键数目之比为___。
③已知室温下TiCl4为无色易溶于乙醇的液体,则TiCl4的晶体类型为___。
(3)配合物[TiCl(H2O)5]Cl2·H2O中,中心离子的配位数是___,向1mol该配合物中加入足量AgNO3溶液,可以得到___molAgCl沉淀。
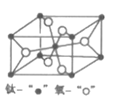
(4)金红石型TiO2的晶胞(α=β=γ=90o)如图所示:TiO2晶体中O原子的配位数是___,其晶胞参数为:a=b=459pm,c=295pm,该晶体密度为___g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
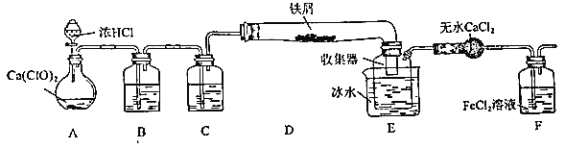
【题目】某学生欲在实验室制备无水 FeCl3 并得到副产物 FeCl3 溶液。经查阅资料得知:无水 FeCl3 在空气中易潮解,加热易升华。如图是他设计的实验装置图(加热及夹持装置略去)
完成下列填空:
(1)装置 A 是 Cl2 发生装置,其中的化学反应方程式为_____
(2)B 中的溶液是_____,C 的作用是_____
(3)D 加热后,少量生成 FeCl3 沉积在D 的右端,要使沉积的 FeCl3 进入E,操作是______________
E 中冰水的作用为_____
(4)实验员老师对上述装置提出了 2 点改进建议:一是装置连接部分都改成标准玻璃接口,不用橡胶连接件的原因是_____;二是这套装置还存在一个很大的缺陷,改进的方法是_______________
(5)证明 F中 FeCl2 未被完全氧化的方法是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一定浓度的一元酸HA溶液和一定浓度的NaOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
|
| ||
① | 0.1 | 0.1 | 9 |
② |
| 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应的溶液中:![]()
B.实验①反应的溶液中:![]()
C.实验②反应的溶液中:![]()
D.实验②反应的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期主族元素,其中
为原子序数依次增大的短周期主族元素,其中![]() 为宇宙中含量最为丰富的元素,
为宇宙中含量最为丰富的元素,![]() 元素形成的简单气态氢化物的熔沸点最高,
元素形成的简单气态氢化物的熔沸点最高,![]() 与
与![]() 和
和![]() 能形成化学式为
能形成化学式为![]() 和
和![]() 的离子化合物,Z的最外层电子数是W、X、Y元素最外层电子数之和的一半。Q为Y的最高价氧化物对应水化物。下列有关说法正确的是( )
的离子化合物,Z的最外层电子数是W、X、Y元素最外层电子数之和的一半。Q为Y的最高价氧化物对应水化物。下列有关说法正确的是( )
A.![]() 离子化合物中阴离子的半径比
离子化合物中阴离子的半径比![]() 小
小
B.Z元素的单质和最高价氧化物均能与Q的溶液反应
C.![]() 元素与
元素与![]() 元素能形成两种化合物,且所含化学键类型相同
元素能形成两种化合物,且所含化学键类型相同
D.![]() 的单质与
的单质与![]() 的溶液反应生成
的溶液反应生成![]() ,转移
,转移![]() 个电子
个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的烧碱溶液,溶液中水所电离的c水(H+)随加入烧碱溶液体积的变化如图所示,下列说法正确的是( )
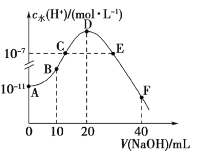
A.B点的溶液中粒子浓度之间存在:c(HA)>c(Na+)>c(A-)
B.由图可知A-的水解平衡常数Kh约为1×10-9
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度之间存在:c(OH-)=c(HA)+c(A-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲探究NH3的催化氧化反应,按如图装置进行实验。A、B装置可选用的药品:浓氨水、H2O2溶液、蒸馏水、NaOH固体、MnO2。

(1)NH3催化氧化的化学方程式是____。
(2)甲、乙两同学分别按如图装置进行实验。一段时间后,装置G中的溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是___。
②乙观察到装置F中只有白烟生成,白烟的成分是___(填化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:___。
(3)为帮助乙实现在装置F中也观察到红棕色气体,如何改进___。
(4)为实现该反应,也可用如图所示的装置替换原装置中虚线框部分。
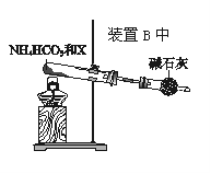
化合物X为__;NH4HCO3的作用是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com