
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期主族元素,其中
为原子序数依次增大的短周期主族元素,其中![]() 为宇宙中含量最为丰富的元素,
为宇宙中含量最为丰富的元素,![]() 元素形成的简单气态氢化物的熔沸点最高,
元素形成的简单气态氢化物的熔沸点最高,![]() 与
与![]() 和
和![]() 能形成化学式为
能形成化学式为![]() 和
和![]() 的离子化合物,Z的最外层电子数是W、X、Y元素最外层电子数之和的一半。Q为Y的最高价氧化物对应水化物。下列有关说法正确的是( )
的离子化合物,Z的最外层电子数是W、X、Y元素最外层电子数之和的一半。Q为Y的最高价氧化物对应水化物。下列有关说法正确的是( )
A.![]() 离子化合物中阴离子的半径比
离子化合物中阴离子的半径比![]() 小
小
B.Z元素的单质和最高价氧化物均能与Q的溶液反应
C.![]() 元素与
元素与![]() 元素能形成两种化合物,且所含化学键类型相同
元素能形成两种化合物,且所含化学键类型相同
D.![]() 的单质与
的单质与![]() 的溶液反应生成
的溶液反应生成![]() ,转移
,转移![]() 个电子
个电子
【答案】B
【解析】
![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期主族元素,其中
为原子序数依次增大的短周期主族元素,其中![]() 为宇宙中含量最为丰富的元素,则W为氢;X元素形成的简单气态氢化物的熔沸点最高,则X为氧;
为宇宙中含量最为丰富的元素,则W为氢;X元素形成的简单气态氢化物的熔沸点最高,则X为氧;![]() 与
与![]() 和
和![]() 能形成化学式为
能形成化学式为![]() 和
和![]() 的离子化合物,能与H形成离子化合物的元素应该是活泼金属,则Y为钠,M为氯;Z的最外层电子数是W、X、Y元素最外层电子数之和的一半,则Z最外层电子数为
的离子化合物,能与H形成离子化合物的元素应该是活泼金属,则Y为钠,M为氯;Z的最外层电子数是W、X、Y元素最外层电子数之和的一半,则Z最外层电子数为![]() ,则Z为硅;Q为Y的最高价氧化物对应水化物,则Q为氢氧化钠。
,则Z为硅;Q为Y的最高价氧化物对应水化物,则Q为氢氧化钠。
A. NaH离子化合物中阴离子为H-,H-与Li+核外电子数相同,核电荷数越大,半径越小,则H-的半径比Li+大,故A错误;
B. Z元素的单质为硅,其最高价氧化物为SiO2,均能与氢氧化钠溶液反应,故B正确;
C. 元素与![]() 元素能形成两种化合物,分别为Na2O和Na2O2,Na2O中只含有离子键,Na2O2中既有离子键又有共价键,所含化学键类型不相同,故C错误;
元素能形成两种化合物,分别为Na2O和Na2O2,Na2O中只含有离子键,Na2O2中既有离子键又有共价键,所含化学键类型不相同,故C错误;
D. 氯气和氢氧化钠溶液反应可以生成NaClO3: 3Cl2+6NaOH=5NaCl+NaClO3+3H2O,则1mol氯气反应式,转移![]()
![]() 个电子,故D错误;
个电子,故D错误;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
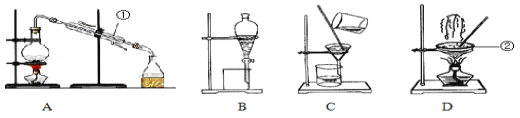
(1)从氯化钾溶液中得到氯化钾固体,选择装置_____(填代表装置图的字母,下同)
(2)从碘水中萃取I2,选择装置_______。
(3)装置A中仪器①的名称为_______,冷凝水的进出方向是______(“上进下出”或“下进上出”)。
Ⅱ.对于混合物的分离或提纯,常采用的方法有:A、分液 B、过滤 C、升华 D、蒸馏 E、结晶 F、加热分解,下列各组物质的分离或提纯,应选用上述方法的哪一种?(填字母序号)
(4)除去CaO中少量CaCO3__________;
(5)除去NaCl固体中少量I2 ________;
(6)除去NaOH溶液中悬浮的CaCO3__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl﹣、NH4+、Mg2+、CO32-、Ba2+、SO42-.将该混合物溶于水后得澄清溶液,现取3份 100 mL该溶液分别进行如下实验:
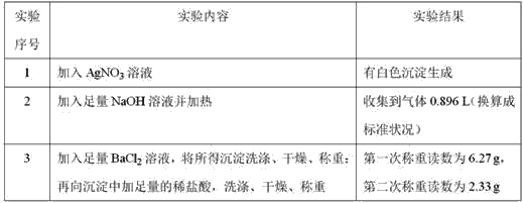
已知加热时NH4++OH﹣![]() NH3↑+H2O,回答下列问题:
NH3↑+H2O,回答下列问题:
(1)判断混合物中Cl﹣是否一定存在__。(填“是”或“否”)
(2)写出溶液中一定存在的离子及其物质的量浓度:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用如图装置(支撑仪器略去)探究乙醇的催化氧化反应。
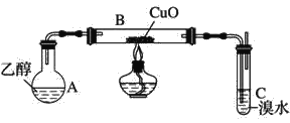
(1)实验开始时,对A进行水浴加热,其目的是__。
(2)B中反应方程式为__。
(3)若装置C中开始发生倒吸,则采取的应急措施是__(填编号)。
a.移去图中的酒精灯 b.将C中橡皮塞拔出
c.将B尾端的乳胶管取下 d.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色。学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br﹣)来确定乙醛使溴水褪色的原因。
①假设:请写出假设1的反应类型。
假设1:CH3CHO+Br2→CH2BrCHO+HBr__;
假设2:CH3CHO+Br2→CH3CHBrOBr 加成反应;
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr 氧化反应。
①结论:若实验测得n(Br2)=0.005mol,n(Br﹣)=0.01mol,则证明假设__正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出_______kJ热量。
(2)如图装置中仪器A的名称是____________,碎泡沫塑料的作用是_____________________________;要重复进行三次实验的目的是 ____________________。
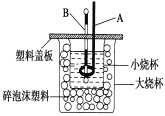
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填“偏大”、“偏小”、“无影响”)。
(4)将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是_____。
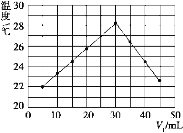
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠![]() 是过氧化物类的消毒剂,可以利用候氏制碱法得到的
是过氧化物类的消毒剂,可以利用候氏制碱法得到的![]() ,进行制备,流程图如下:
,进行制备,流程图如下:
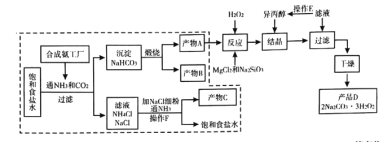
已知:①产物![]() 中可能含有少量的
中可能含有少量的![]() 、
、![]() 金属离子杂质。②硅酸钠可与
金属离子杂质。②硅酸钠可与![]() 、
、![]() 等高价金属离子形成沉淀。
等高价金属离子形成沉淀。
请回答下列问题:
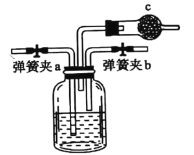
(1)虚线框中是侯氏制碱法的原理,某同学用右图装置在实验室模拟侯氏制碱法,实验中应先打开弹簧夹________(填![]() 或
或![]() ),通入________气体。
),通入________气体。
(2)索尔维制碱法是利用石灰石分解制备![]() ,并用生成的
,并用生成的![]() 和
和![]() 反应制备氨气,将
反应制备氨气,将![]() 和
和![]() 通人饱和食盐水制备
通人饱和食盐水制备![]() 晶体,分离提纯后分解制备纯碱。与索尔维制碱法相比,侯氏制碱法的优点是(至少写两点)________。
晶体,分离提纯后分解制备纯碱。与索尔维制碱法相比,侯氏制碱法的优点是(至少写两点)________。
(3)“反应”需控制温度在![]() 左右,写出“反应”中生成产品
左右,写出“反应”中生成产品![]() 的化学方程式________,加
的化学方程式________,加![]() 的作用是________。
的作用是________。
(4)流程图中可循环使用的物质有________。
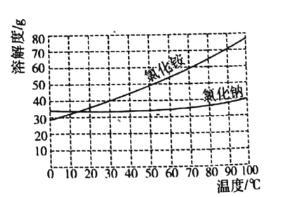
(5)操作![]() 的主要步骤有________(已知
的主要步骤有________(已知![]() 和
和![]() 的溶解度曲线如图所示)
的溶解度曲线如图所示)
(6)为了测定产品![]() 的纯度,某小组的方法是:取
的纯度,某小组的方法是:取![]() 产品配成
产品配成![]() 的溶液,取出
的溶液,取出![]() 用
用![]() 用硫酸酸化的
用硫酸酸化的![]() 溶液滴定至终点,该滴定过程中消耗高锰酸钾标准溶液的体积为
溶液滴定至终点,该滴定过程中消耗高锰酸钾标准溶液的体积为![]() 。产品的纯度为________%(用含有
。产品的纯度为________%(用含有![]() 和
和![]() 的式子表示)。
的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定一定条件下气体的体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低。回答下列问题:

(1)写出锌和稀硫酸反应的化学方程式:__________________________________。
(2)已知:该条件下H2的密度为0.087 0 g·L-1,如果甲管的刻度最大值是100 mL,则实验中称取锌片的最大质量是__________g。
(3)为了准确地测量H2的体积,在读取反应后甲管中液面的读数时,应注意________(填写序号)。
A.视线与凹液面最低处相平
B.等待片刻,待乙管液面不再上升时读数
C.读数时应上、下移动乙管,使甲、乙两管液面相平
D.读数不一定使甲、乙两管液面相平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:(已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol)
2NH3(g) △H=-92.4kJ/mol)

下列说法正确的是( )
A.2c1>c3B.a+b<92.4C.2p1<p3D.a1+a3<1
查看答案和解析>>
科目:高中化学 来源: 题型:
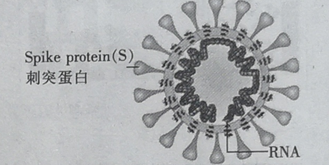
【题目】冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构成.下列说法错误的是
A.蛋白质和核酸均是高分子化合物
B.蛋白质中含C、H、O、N 等元素
C.五碳糖( C5H10O5)与葡萄糖互为同系物
D.NaClO溶液用作消毒剂,是因为NaClO 能使病毒蛋白变性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com