
����Ŀ��Ϊ�˲ⶨһ����������������������ͼ��ʾ��װ�ú�����ʵ��ҩƷ����һ����пƬ��������ϡ�������Թ�A�з�Ӧ��������B���ɼס���������������ɣ���������Ƥ����ͨ����װ����ˮ�����п̶ȣ��ס��ҹܿɹ̶�������̨�ϣ��������ã��ҹܿ������ƶ����Ե���Һ��ߵ͡��ش��������⣺

(1)д��п��ϡ���ᷴӦ�Ļ�ѧ����ʽ��__________________________________��
(2)��֪����������H2���ܶ�Ϊ0.087 0 g��L��1������ܵĿ̶����ֵ��100 mL����ʵ���г�ȡпƬ�����������__________g��
(3)Ϊ��ȷ�ز���H2��������ڶ�ȡ��Ӧ�����Һ��Ķ���ʱ��Ӧע��________(��д���)��
A�������밼Һ����ʹ���ƽ
B���ȴ�Ƭ�̣����ҹ�Һ�治������ʱ����
C������ʱӦ�ϡ����ƶ��ҹܣ�ʹ�ס�������Һ����ƽ
D��������һ��ʹ�ס�������Һ����ƽ
���𰸡�Zn��H2SO4===ZnSO4��H2�� 0.283 ABC
��������
(1)п��ϡ���ᷴӦ��������п��������
(2)���÷���ʽ���㣻
(3)Ϊ�˽�ȷ�ز���������������ٶ���ʱҪ���ڼס��ҵ�Һ��ʹ��ͬһ�߶ȣ��ڶ���ʱ����Ҫ�밼Һ����ʹ���ƽ�����¶Ȼָ������£����ҹ�Һ�治������������
(1)п��ϡ���ᷴӦ��������п����������Ӧ����ʽΪZn��H2SO4===ZnSO4��H2����
(2)��п���������Ϊxg��
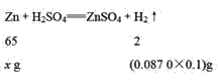
�з��̣�����x��0.283 g��
(3)Ϊ�˽�ȷ�ز�����������������˱���������װ�õ�������֮�⣬����ʱӦע�⣺�ٶ���ʱҪ���ڼס��ҵ�Һ��ʹ��ͬһ�߶ȣ��Ա�֤�����ѹ�������������ڶ���ʱ����Ҫ�밼Һ����ʹ���ƽ���۴��ҹ�Һ�治������ʱ��Ҳ�����¶Ȼָ������£��Զ�������������������������ȷѡ��ΪABC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����淴ӦA(g)��3B(g) ![]() 2C(g)���ﵽƽ��ı�־��
2C(g)���ﵽƽ��ı�־��
A.C���ɵ�������C�ֽ���������
B.A��B��C��Ũ�����
C.��λʱ��������n molA��ͬʱ����2nmol C
D.��λʱ��������n molA��ͬʱ����3nmol B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���һ��Ũ�ȵ�һԪ��HA��Һ��һ��Ũ�ȵ�NaOH��Һ�������ϣ���������仯����ʵ���������±���
ʵ���� | ��ʼŨ�ȣ�mol/L�� | ��Ӧ����Һ��pH | |
|
| ||
�� | 0.1 | 0.1 | 9 |
�� |
| 0.2 | 7 |
�����жϲ���ȷ���ǣ� ��
A.ʵ��ٷ�Ӧ����Һ�У�![]()
B.ʵ��ٷ�Ӧ����Һ�У�![]()
C.ʵ��ڷ�Ӧ����Һ�У�![]()
D.ʵ��ڷ�Ӧ����Һ�У�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() Ϊԭ��������������Ķ���������Ԫ�أ�����
Ϊԭ��������������Ķ���������Ԫ�أ�����![]() Ϊ�����к�����Ϊ�ḻ��Ԫ�أ�
Ϊ�����к�����Ϊ�ḻ��Ԫ�أ�![]() Ԫ���γɵļ���̬�⻯����۷е���ߣ�
Ԫ���γɵļ���̬�⻯����۷е���ߣ�![]() ��
��![]() ��
��![]() ���γɻ�ѧʽΪ
���γɻ�ѧʽΪ![]() ��
��![]() �����ӻ����Z��������������W��X��YԪ������������֮�͵�һ�롣QΪY������������Ӧˮ��������й�˵����ȷ���ǣ� ��
�����ӻ����Z��������������W��X��YԪ������������֮�͵�һ�롣QΪY������������Ӧˮ��������й�˵����ȷ���ǣ� ��
A.![]() ���ӻ������������ӵİ뾶��
���ӻ������������ӵİ뾶��![]() С
С
B.ZԪ�صĵ��ʺ���������������Q����Һ��Ӧ
C.![]() Ԫ����
Ԫ����![]() Ԫ�����γ����ֻ������������ѧ��������ͬ
Ԫ�����γ����ֻ������������ѧ��������ͬ
D.![]() �ĵ�����
�ĵ�����![]() ����Һ��Ӧ����
����Һ��Ӧ����![]() ��ת��
��ת��![]() ������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2 L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ��
(1)���Һ�У�NaCl�����ʵ���Ϊ_______mol��MgCl2������Ϊ_______g��
(2)�û����Һ��CuCl2�����ʵ���Ũ��Ϊ_____molL��1�����û����Һ��ˮϡ�������Ϊ1 L��ϡ�ͺ���Һ��Cu2+�����ʵ���Ũ��Ϊ_______molL��1��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ܱ������У���ӦaA(g)![]() bB(g)��ƽ������¶Ȳ��䣬������������룬���ﵽ�µ�ƽ��ʱ��A��Ũ������Ϊԭ����1.8����������˵���������(����)
bB(g)��ƽ������¶Ȳ��䣬������������룬���ﵽ�µ�ƽ��ʱ��A��Ũ������Ϊԭ����1.8����������˵���������(����)
A.ƽ��������Ӧ�����ƶ���
B.����A��ת����������
C.���º�ѹʱ�ٳ���A���ʣ��ﵽ�µ�ƽ��ʱA����������������
D.a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL0.1mol��L-1��HA��Һ����μ���0.1mol��L-1���ռ���Һ����Һ��ˮ�������cˮ��H+��������ռ���Һ����ı仯��ͼ��ʾ������˵����ȷ���ǣ� ��
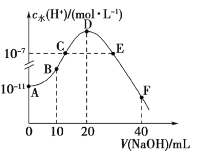
A.B�����Һ������Ũ��֮����ڣ�c(HA)��c(Na+)��c(A-)
B.��ͼ��֪A-��ˮ��ƽ�ⳣ��KhԼΪ1��10-9
C.C��E������Ϊ��ˮ�ĵ�����������úʹٽ�������ͬ��������Һ��������
D.F�����Һ�ʼ��ԣ�����Ũ��֮����ڣ�c(OH-)=c(HA)+c(A-)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��Ӧ��:Fe(s)+CO2(g)![]() FeO(s)+CO(g),�仯ѧƽ�ⳣ��ΪK1;��ѧ��Ӧ��:Fe(s)+H2O(g)
FeO(s)+CO(g),�仯ѧƽ�ⳣ��ΪK1;��ѧ��Ӧ��:Fe(s)+H2O(g)![]() FeO(s)+H2(g),�仯ѧƽ�ⳣ��ΪK2,���¶�973 K��1173 K�������,K1��K2��ֵ�ֱ�����:
FeO(s)+H2(g),�仯ѧƽ�ⳣ��ΪK2,���¶�973 K��1173 K�������,K1��K2��ֵ�ֱ�����:
�¶� | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)ͨ�������е���ֵ�����ƶ�:��Ӧ����_______(��������������������)��Ӧ��
(2)���з�Ӧ��:CO2(g)+H2(g)![]() CO(g)+H2O(g),����д���÷�Ӧ��ƽ�ⳣ��K3�ı���ʽ:K3=______��
CO(g)+H2O(g),����д���÷�Ӧ��ƽ�ⳣ��K3�ı���ʽ:K3=______��
(3)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵʽΪ__________,�ݴ˹�ϵʽ���ϱ�����,���ƶϳ���Ӧ����________(��������������������)��Ӧ��
(4)Ҫʹ��Ӧ����һ�������½�����ƽ��������Ӧ�����ƶ�,�ɲ�ȡ�Ĵ�ʩ��______ ��_____ (��д��ĸ���)��
A.��С��Ӧ�������ݻ� B.����Ӧ�������ݻ�
C.�����¶� D.ʹ�ú��ʵĴ���
E.�跨��Сƽ����ϵ�е�CO��Ũ��
(5)ͼ�ס��ҷֱ��ʾ��Ӧ����t1ʱ�̴ﵽƽ��,��t2ʱ����ı�ij�������������仯�����:
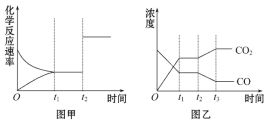
��ͼ����t2ʱ�̷����ı��������__________��
��ͼ����t2ʱ�̷����ı��������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һƿ���ýϳ�ʱ���![]() ��Һ��ȡ��20mL�������Һ����μ���
��Һ��ȡ��20mL�������Һ����μ���![]() ��������������Ӧ������
��������������Ӧ������![]() ��������ʵ������������������ϵ��ͼ��ʾ(����
��������ʵ������������������ϵ��ͼ��ʾ(����![]() �ܽ��
�ܽ��![]() �ӷ�)����ش��������⣺
�ӷ�)����ش��������⣺

(1)O-a�η�����Ӧ�����ӷ���ʽΪ______________________��______________________��
(2)O����Һ���������ʵ����ʵ���Ϊ___________��___________��
(3)ԭ![]() ��Һ�����ʵ���Ũ��Ϊ_____________��
��Һ�����ʵ���Ũ��Ϊ_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com