
【题目】钛及其化合物应用广泛。
(1)(钛元素基态原子核外最外层电子的自旋状态___(填“相同”或“相反”)。
(2)已知一定条件下TiO2与TiCl4之间可以相互转化:TiO2![]() TiCl4。
TiCl4。
①Ti、Cl、O三种元素电负性由大到小的顺序为___。
②COCl2的分子构型为___,键角大小比较∠Cl—C—O___∠C1—C—Cl(填“>”或“<”),σ键和π键数目之比为___。
③已知室温下TiCl4为无色易溶于乙醇的液体,则TiCl4的晶体类型为___。
(3)配合物[TiCl(H2O)5]Cl2·H2O中,中心离子的配位数是___,向1mol该配合物中加入足量AgNO3溶液,可以得到___molAgCl沉淀。
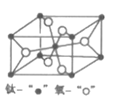
(4)金红石型TiO2的晶胞(α=β=γ=90o)如图所示:TiO2晶体中O原子的配位数是___,其晶胞参数为:a=b=459pm,c=295pm,该晶体密度为___g/cm3(列出计算式)。
【答案】相反 O>Cl>Ti 平面三角形 > 3 分子晶体 6 2 3 ![]()
【解析】
(1)钛为22号元素,根据价电子排布式分析;
(2)①元素原子的得电子能力越强,则电负性越大;
②根据1个单键是1个σ键,1个双鍵中含有1个σ键,1个π键以及COCl2分子的结构式来解答;
③通常低熔点、易溶于有机溶剂的晶体属于分子晶体;
(3)配合物[TiCl(H2O)3]Cl2·H2O中,配位体是内界的1个Cl-和5个H2O;
(4)根据均摊法结合晶胞数据分析解答。
(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布式为3d24s2,原子核外最外层电子数为2,自旋状态相反;
(2)①元素原子的得电子能力越强,则电负性越大,所以O>Cl>Ti;
②COCl2的结构为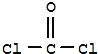 ,中心原子C上含有3个σ键,没有孤电子对,属于sp2杂化,其分子构型为平面三角形;
,中心原子C上含有3个σ键,没有孤电子对,属于sp2杂化,其分子构型为平面三角形;
在COCl2分子中, C原子为sp2杂化,虽然等性sp2杂化的键角是120°。但由于C原子与O原子间以双键C=O结合,该双键对C-Cl键的斥力要更大些。所以,∠O-C-Cl键角要大于∠Cl-C-Cl键角;答案为>;
COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键数目为1,个数之比为3:1;
③通常低熔点、易溶于有机溶剂的晶体属于分子晶体,则TiCl4的晶体类型为分子晶体;
(3)配合物[TiCl(H2O)5]Cl2·H2O中,配位体是内界的1个Cl-和5个H2O,中心离子的配位数是6,作为配体的Cl-难以电离出来与Ag+发生反应,故向1mol该配合物中加入足量AgNO3溶液,可以得到2molAgCl沉淀;
(4)根据均摊法,晶胞中有2个原子和4个O原子,因此晶胞质量=![]() ,晶胞体积=459
,晶胞体积=459![]() ,因此,晶胞密度=
,因此,晶胞密度=![]() 。
。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】某硝酸厂处理尾气中NO的方法是在催化剂存在下,用H2将NO还原为N2,其热化学方程式为NO(g)+H2(g)=![]() N2(g)+H2O(g) ΔH=mkJ·mol-1,其能量变化过程如图:
N2(g)+H2O(g) ΔH=mkJ·mol-1,其能量变化过程如图:
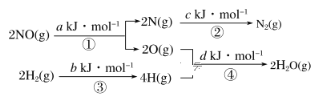
下列说法正确的是( )
A.过程①、②、③、④都是放热过程B.m=+![]() (a+b-c-d)kJ·mol-1
(a+b-c-d)kJ·mol-1
C.m=-![]() (c+a-d-b)kJ·mol-1D.m=+
(c+a-d-b)kJ·mol-1D.m=+![]() (c+d-a-b) kJ·mol-1
(c+d-a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是

A. 电解质溶液中Na+向b极移动
B. b极的电极反应是:O2+2H2O+4e-=4OH-
C. a极是负极,发生氧化反应
D. 电子通过外电路从b电极流向a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理烟气中的SO2,可以采用碱吸-电解法,其流程如图:模拟过程Ⅱ如图,下列推断正确的是( )
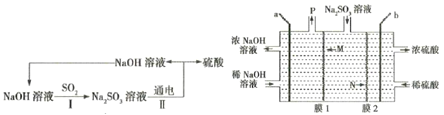
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.SO2是含有极性键的极性分子
C.a极的电极反应式为2H2O-4e-=4H++O2↑
D.若收集22.4 L的P(标准状况下),则有2 mol N离子移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
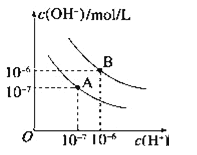
(1)95℃时水的离子积KW=_____.
(2)95℃时,0.01mol/LNaOH溶液的PH=_____.
(3)95℃时水的电离平衡曲线应为___(填“A”或“B”),请说明理由______________________.
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(5)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
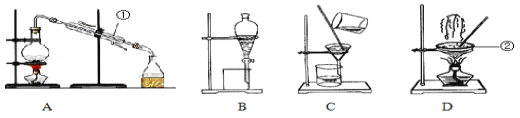
(1)从氯化钾溶液中得到氯化钾固体,选择装置_____(填代表装置图的字母,下同)
(2)从碘水中萃取I2,选择装置_______。
(3)装置A中仪器①的名称为_______,冷凝水的进出方向是______(“上进下出”或“下进上出”)。
Ⅱ.对于混合物的分离或提纯,常采用的方法有:A、分液 B、过滤 C、升华 D、蒸馏 E、结晶 F、加热分解,下列各组物质的分离或提纯,应选用上述方法的哪一种?(填字母序号)
(4)除去CaO中少量CaCO3__________;
(5)除去NaCl固体中少量I2 ________;
(6)除去NaOH溶液中悬浮的CaCO3__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是_______。
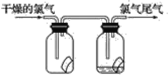
(2)为防止氯气尾气污染空气,实验室通常用________溶液吸收多余的氯气,原理是______________________(用化学方程式表示)。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是________________(填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为_____________________,长期露置于空气中的漂白粉,加稀盐酸后产生的气体是________(填字母,下同)。
A.O2B.Cl2 C.CO2D.HClO
(3)一旦发生氯气泄漏和爆炸事故,周围群众应紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度某物质水溶液的毛巾捂住鼻子,最适宜采用的该物质是________。
A.NaOH B.NaCl
C.KCl D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中橙色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O![]() 2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.
2CrO42-+2H+把重铬酸钾K2Cr2O7溶于水配成的稀溶液是橙色的.
(1)向上述溶液中加入NaOH溶液,溶液呈 ______ 色
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈 ______ 色
(3)向原溶液中逐渐加入足量硝酸钡溶液![]() 已知BaCrO4为黄色沉淀
已知BaCrO4为黄色沉淀![]() ,则平衡 ______
,则平衡 ______ ![]() 填“向左移动”或“向右移动”
填“向左移动”或“向右移动”![]() ,溶液颜色将 ______ .
,溶液颜色将 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出_______kJ热量。
(2)如图装置中仪器A的名称是____________,碎泡沫塑料的作用是_____________________________;要重复进行三次实验的目的是 ____________________。
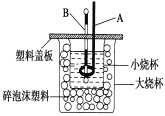
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填“偏大”、“偏小”、“无影响”)。
(4)将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是_____。
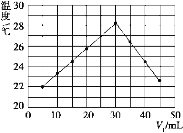
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com