
【题目】在2 L密闭容器内,800 ℃时,0.02molNO(g)和0.01molO2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为_______。
(2)如图中表示NO2变化曲线的是________,用O2表示从0~2 s内该反应的平均速率v=________。
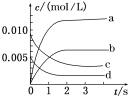
(3)能说明该反应已达到平衡状态的是________。
a v(NO2)=2v(O2) b 容器内压强保持不变
c v逆(NO)=2v正(O2) d 容器内密度保持不变
【答案】是 65% b 0.001 5 mol/(L·s) bc
【解析】
一氧化氮和氧气发生反应的化学方程式为:2NO(g)+O2(g)= 2NO2(g),据此分析解答。
(1)由表可知,NO不能反应完,说明该反应是可逆反应,由图可知,5s时,NO转化的物质的量=0.020mol-0.007mol=0.013mol,所以NO的转化率=![]() =65%,故答案为:是;65%;
=65%,故答案为:是;65%;
(2)从方程式来看,NO2和NO的变化量相等,从图来看NO的浓度变化量=0.01mol/L-0.0035mol/L=0.0065mol/L,a曲线浓度变化量=0.011mol/L,b曲线浓度变化量=0.0065mol/L,所以b曲线代表NO2变化曲线。0到2s,NO的物质的量变化量=0.020mol-0.008mol=0.012mol,NO的浓度变化量=![]() =0.006mol/L,所以v(NO)=
=0.006mol/L,所以v(NO)=![]() mol/(L·s),所以v(O2)=
mol/(L·s),所以v(O2)=![]() v(NO)=
v(NO)=![]() ×0.003mol/(L·s)=0.0015mol /(L·s),故答案为:b;0.0015mol /(L·s);
×0.003mol/(L·s)=0.0015mol /(L·s),故答案为:b;0.0015mol /(L·s);
(3)2NO(g)+O2(g)= 2NO2(g)
a.没有指明逆反应速率还是正反应速率,a错误;
b.该反应是气体分子数减少的反应,压强不变时,表面已平衡,b正确;
c.v逆(NO)=2v逆(O2),因为 v逆(NO)=2v正(O2),所以v逆(O2)= v正(O2),c正确;
d.容器体积不变,气体总质量不变,该反应任何时候容器内密度都不变,所以容器内密度保持不变不能说明达到化学平衡,d错误;
故答案为:bc。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】如图所示的装置中, a、b为石墨电极,通电一段时间后,b极附近显红色。下列说法不正确的是

A. b电极反应式为2H++2e-=H2↑B. a电极反应式为2Cl--2e-=Cl2↑
C. 铁电极反应式为Cu2++2e-=CuD. 铜电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s)![]() Ca(OH)2(aq)
Ca(OH)2(aq)![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是
A. n (Ca2+)增大 B. c(Ca2+)不变
C. c(OH-)增大 D. n(OH-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
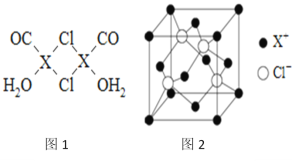
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2·2CO·2H2O
(1)X基态原子的电子排布式为__________________.
(2)C、H、O三种原子的电负性由大到小的顺序为__________.
(3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示:
①与CO为互为等电子体的分子是_________.
②该配合物中氯原子的杂化方式为__________.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键_____________.
(4)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对XCl晶体的X射线衍射图象的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl﹣的个数为____________,若X原子的半径为a pm,晶体的密度为ρg/cm3,试通过计算阿伏加德罗常数NA=___________________(列计算式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的实验装置和方法进行实验,能达到目的的是( )
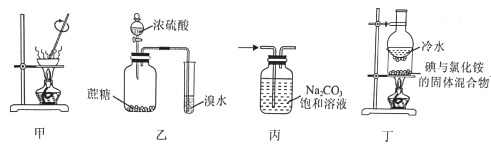
A.甲装置可将AlCl3溶液蒸干获得AlCl3晶体
B.乙装置可证明浓硫酸具有脱水性和氧化性
C.丙装置可除去CO2中的HCl
D.丁装置可将NH4Cl固体中的I2分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在t ℃时,Ag2CrO4的Ksp=1×10-9
B.X点有Ag2CrO4沉淀生成
C.通过加热蒸发可以使溶液由Y点变到Z点
D.在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点变到X点最终变到Z点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应A(g)+2B(g)=3C(g)+4D(g)中,表示该反应速率最快的是
A.v(A)=0.5mol/(L·s)
B.v(B)=0.5mol/(L·s)
C.v(C)=0.8mol/(L·s)
D.v(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___Fe2++___ClO-+___=___Fe(OH)3↓+___C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___(填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)212H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___。
(2)实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___。
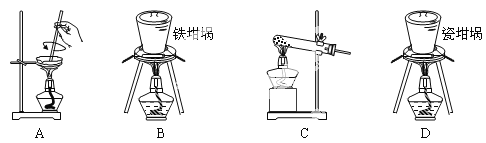
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂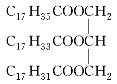 能发生的反应有( )
能发生的反应有( )
①皂化反应 ②使高锰酸钾酸性溶液褪色 ③使溴水褪色 ④氧化反应 ⑤还原反应 ⑥加成反应
A.①⑤B.①②③④
C.①④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com