
| n |
| V |
|
| 1.12L |
| 22.4L/mol |
| 0.05mol×4 |
| 5-4 |
| 2.24L |
| 22.4L/mol |
|
| 1mol |
| 0.1L |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
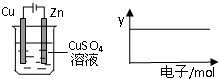 按如图装置实验,若x轴表示流入阴极的电子的物质的量,(假设溶液的体积不变)则不能用y轴表示的是( )
按如图装置实验,若x轴表示流入阴极的电子的物质的量,(假设溶液的体积不变)则不能用y轴表示的是( )| A、c(Cu2+) |
| B、c(SO42-) |
| C、Cu棒的质量 |
| D、溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其分子式为
,其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| VA |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na+2H2O=2NaOH+H2↑是酸碱反应 |
| B、C1O-+H2O?HClO+OH-是酸碱反应 |
| C、碱性强弱顺序:ClO->OH->CH3COO- |
| D、HCO3-既是酸又是碱,NH3既不是酸又不是碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com