
����Ŀ��һ����ʯī���ɽ������������缫���ϡ��Թ�̬�л��߾�����������ܼ�������ӵ�أ��ŵ�ʱ�� �ܷ�Ӧ����ʽΪ��Li(1-x)CoO2+LixC6=LiCoO2+C6(x��1)���乤��ԭ����ͼ1��ʾ��ͼ2�Ǻϳ��л��߾���ĵ���Ľṹ��ʽ������˵���У���ȷ����


A. �ŵ�ʱ�����·�����ɽ���������缫����ʯī�缫
B. ���ʱ��ʯī�缫�����������ɽ���������������
C. �ŵ�ʱ������ӦΪ��LiC6-xe-=Li(1-x)C6+xLi+
D. ͼ2��ʾ�����ֵ����ͨ�����۷�Ӧ�����л��߾����ܼ�
���𰸡�C
��������
�ŵ�ʱ�ķ�ӦΪLi1-xCoO2+LixC6�TLiCoO2+C6��CoԪ�صĻ��ϼ۽��ͣ�Co�õ����ӣ���Li1-xCoO2Ϊ������LixC6Ϊ������LixC6ʧȥ���ӵõ�Li+�����ԭ����и�������������Ӧ������������ԭ��Ӧ������Ƿŵ������̣��ݴ˽��
A������ͼʾ����֪��ʯī�Ǹ������ŵ�ʱ�����ӴӸ�����������������ʯī�缫�������������缫����A����
B�����ʱ��ʯī�缫�����������Ƚ�������������������B����
C���ŵ�ʱ������LixC6ʧȥ���Ӳ���Li+���缫��ӦʽΪLiC6-xe-=Li(1-x)C6+xLi+����C��ȷ��
D��ͼ2��ʾ�����ֵ��庬��̼̼˫������ͨ���Ӿ۷�Ӧ�����л��߾����ܼ�����D����
�ʴ�ΪC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ij�¶��£�һԪ����HA��KaԽС����NaA��Kh(ˮ��ƽ�ⳣ��)ԽС
B. ���ܶ�п��ֲ�����������Բ�������
C. ͭ�ȿ��Է������ⸯʴ�ֿ��Է���������ʴ
D. �����ú����������C2H5OH��CH3OCH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��W��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ����֪X��һ�ֺ��ص�������Ϊ18��������Ϊ10��Y��Neԭ�ӵĺ�������������1��W�ĵ�����һ�ֳ����İ뵼����ϣ�Z�ķǽ�������ͬ��������Ԫ������ǿ��

��ش��������⣺
(1)Wλ��Ԫ�����ڱ��е�________���ڵ�________�塣����X�������ӵĽṹʾ��ͼ��____________��
(2)Z���⻯����廯����ȣ����ȶ�����________(д����ʽ)��
(3)Y�Ľ�������Mg�Ľ�������ȣ�________�Ľ�����ǿ(д��ѧʽ)������ʵ��֤�����ǽ����Ե����ǿ����___________��
(4)д��Y������������Ӧ��ˮ������Z������������Ӧ��ˮ�������Ӧ�Ļ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���Һ������Զ�TiO2���Ⱦ��R���ⷴӦ��Ӱ����ͼ��ʾ�������ж���ȷ����

A.��0-50min֮�䣬 pH =2 �� PH= 7 ʱ R �Ľ���ٷ������
B.��Һ����Խǿ�� R �Ľ�������ԽС
C.R����ʼŨ��ԽС����������Խ��
D.�� 20-25min֮�䣬 pH = 10 ʱ R ��ƽ����������Ϊ 0.04mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ͨ������SiO2 ��̼��Ӧ����ȡ�裬д����Ӧ�Ļ�ѧ����ʽ___________________��
��ҵ�ϻ���������þ��ȡ�裬��ӦΪ2Mg+SiO2 = 2MgO+Si��ͬʱ�ᷢ������Ӧ��2Mg + Si = Mg2Si����ͼ�ǽ���Mg��SiO2��Ӧ��ʵ��װ�ã��Իش��������⣺

��1������O2��H2O��g���Ĵ��ڶԸ�ʵ���нϴ�Ӱ�죬ʵ����Ӧͨ������X��Ϊ���������Թ��еĹ���ҩƷ��ѡ��________(�����)��
a��ʯ��ʯ������b��п��������c������
��2��ʵ�鿪ʼʱ��������ͨһ��ʱ��X���壬�ټ��ȷ�Ӧ��������� ___________________________������Ӧ���������߾ƾ��ƣ���Ӧ�ܼ������У���ԭ����______________________��
��3����Ӧ��������ȴ������ʱ������Ӧ��Ļ�����м���ϡ���ᣬ�ɹ۲쵽�����Ļ��ǣ������������ԭ���Ǹ�����Mg2Si������Ѹ�ٷ�Ӧ����SiH4�����飩���壬Ȼ��SiH4��ȼ���û�ѧ����ʽ��ʾ��������Ӧ��________________________��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3����ԭNO����Ҫ�����������������䷴Ӧ������������ϵ��ͼ;�о���������Fe2O3Ϊ���Ĵ����Ͽ��ܷ����ķ�Ӧ��������ͼ������˵����ȷ����( )

A. �������ܷ�ӦΪ��4NH3(g)��4NO(g)��O2(g)![]() 4N2(g)��6H2O(g)
4N2(g)��6H2O(g)
B. NH3����ԭNOΪ���ȷ�Ӧ
C. ����1��NH3���ѷǼ��Լ�
D. ������NOΪ��������Fe2+Ϊ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ����β���е�NO���������¼��ַ�����
��1���������������ϰ�װ��ת������NO��CO�����Ϊ����β���ijɷ֣������������ڴ�ת�����з�����Ӧ��2CO(g)��2NO(g)![]() N2(g)��2CO2(g) ��H ��
N2(g)��2CO2(g) ��H ��
����֪��N2(g)+O2(g)=2NO(g)��H1����180.5kJ��mol��1��C(s)+O2(g)=CO2(g) ��H2����393.5 kJ��mol��1��2C(s)+O2(g)=2CO(g)��H3����221kJ��mol��1������H=______��
��һ����ȤС���ij����������ʱ��β��������������CO��NO�ٷֺ�����ʱ��仯��ͼ1��ʾ��ǰ0��10s �Σ�CO��NO�ٷֺ���û���Ա仯��ԭ����_____________________��ͬʱ��С���ڹ̶��ݻ�Ϊ2L���ܱ�������ͨ��NO��CO��2mol���з�Ӧ��n(CO2)���¶ȣ�T����ѹǿ��P����ʱ�䣨t���ı仯������ͼ2��ʾ��ͼ�е�����������������Ӧ��Ӧ�ӿ�ʼ��ƽ��ʱ��CO2��ʾ��ƽ����Ӧ���ʷֱ�Ϊv(��)��v��������v�������������ߴ�С��ϵΪ______________��
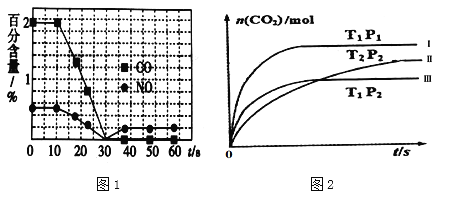
��2������̿Ҳ�����ڴ�������β���е�NO����1L�����ܱ������м���0.1000molNO��2.030mol�������̿������CO2��N2�������壬�ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ����Լ�������ѹǿ���±���
����̿/mol | NO/mol | CO2/mol | N2/mol | P/MPa | |
200�� | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
X | 2.005 | 0.0500 | 0.0250 | 0.0250 | 4.56 |
�����з�����Ӧ�Ļ�ѧ����ʽΪC(s) +2NO(g) CO2(g) +N2(g)�������ϱ����ݣ����ж�X_____200������������������������=����գ������㷴Ӧ��ϵ��200��ʱ��ƽ�ⳣ��Kp=_____����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�������������
��3���ü�ӵ绯ѧ����ȥNO�Ĺ��̣���ͼ��ʾ����֪���ص�����������Һ��pH��4~7֮�䣬B��Ϊ_________(��������������������)��д��A���ĵ缫��Ӧʽ��____________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɲ��������л�ѧԭ��
(1)���������Ȼ�����Һʱ��Ϊ�˷�ֹ����ˮ�⣬���Լ���������________��
(2)��AlCl3��Һ���ɣ����գ����õ�����Ҫ���������____________��
(3)��ȥCuCl2��Һ��������FeCl3��������Լ�������_____________��
(4)�ڳ����£�ϡ�͵�PHֵ��HCl��HF�������ϡ��Һʱ����ҺpH���ˮ���ı仯��ͼ��ʾ���ܱ�ʾHF��ϡ���̵������ǣ�_____________

(5)amol��L��1(NH4 )2SO4��ҺpH=5����ԭ����_______(����Ӧ�ķ���ʽ˵��)��
(6)��4�ֻ����Һ���ֱ��ɵ����0.1 mol��L��1��������Һ��϶��ɣ���NH4Cl�� CH3COONa����NH4Cl��HCl����NH4Cl��NaCl����NH4Cl��NH3��H2O(���Һ�ʼ���)����Һ��c(H��)��С������˳��Ϊ��(������Һ�ı��)____________
(7)����Zn��ϡH2SO4��Ӧ��ȡH2��ʵ���У�����Һ�еμӼ���CuSO4��Һ����Ӧ�ų�H2�ٶȼӿ��ԭ���ǣ�__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA(g)��B(g) ![]() C(g)��D(g)�����е������仯��ͼ��ʾ������˵����ȷ����
C(g)��D(g)�����е������仯��ͼ��ʾ������˵����ȷ����

A. ��Ӧ��ļ����ܺʹ���������ļ����ܺ�
B. �����¶ȣ�����A��ת��������
C. �������ʱ�����Խ��ͷ�Ӧ��
D. ����ѹǿ���ܹ����̷�Ӧ�ﵽƽ��״̬��ʱ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com