
【题目】完成并分析下列化学原理
(1)在配制三氯化铁溶液时,为了防止发生水解,可以加入少量的________。
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________;
(3)除去CuCl2溶液中少量的FeCl3,加入的试剂可以是_____________。
(4)在常温下,稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH随加水量的变化如图所示,能表示HF的稀释过程的曲线是:_____________

(5)amol·L-1(NH4 )2SO4溶液pH=5,其原因是_______(用相应的方程式说明)。
(6)有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与 CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)。溶液中c(H+)由小到大的顺序为:(填混合溶液的编号)____________
(7)在做Zn与稀H2SO4反应制取H2的实验中,向溶液中滴加几滴CuSO4溶液,反应放出H2速度加快的原因是:__________________________
【答案】稀盐酸或稀HCl Al2O3 或氧化铝 氧化铜、氢氧化铜、碳酸铜、碱式碳酸铜 HB NH4+ + H2O![]() NH3·H2O+H+ ④< ①< ③< ② 形成锌—铜—稀硫酸原电池,加快反应速率
NH3·H2O+H+ ④< ①< ③< ② 形成锌—铜—稀硫酸原电池,加快反应速率
【解析】
(1)三氯化铁为强酸弱碱盐,铁离子水解呈酸性;
(2)铝离子水解生成的盐酸为挥发性酸,蒸干得到氢氧化铝,再灼烧分解生成氧化铝;
(3)FeCl3 + 3H2O ![]() Fe(OH)3 + 3HCl,加入的试剂要消耗HCl而使平衡正向移动,使Fe(OH)3 变为沉淀过滤除去,但不能引入新杂质;
Fe(OH)3 + 3HCl,加入的试剂要消耗HCl而使平衡正向移动,使Fe(OH)3 变为沉淀过滤除去,但不能引入新杂质;
(4)稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH变化大的酸性较强,所以HA的酸性强,HB的酸性弱,;
(5)(NH4 )2SO4是强酸弱碱盐,NH4+水解显酸性;
(6)酸性越强,pH越小;
(7)形成锌—铜—稀硫酸原电池,加快反应速率。
(1)三氯化铁为强酸弱碱盐,铁离子水解呈酸性,配制三氯化铁溶液时,要抑制铁离子水解,加少量的盐酸,故答案为:稀盐酸或稀HCl;
(2)铝离子水解生成的盐酸为挥发性酸,蒸干得到氢氧化铝,再灼烧分解生成氧化铝,故答案为:Al2O3 或氧化铝;
(3)FeCl3 + 3H2O ![]() Fe(OH)3 + 3HCl,加入的试剂要消耗HCl而使平衡正向移动,使Fe(OH)3 变为沉淀过滤除去,但不能引入新杂质,故答案为:氧化铜、氢氧化铜、碳酸铜、碱式碳酸铜;
Fe(OH)3 + 3HCl,加入的试剂要消耗HCl而使平衡正向移动,使Fe(OH)3 变为沉淀过滤除去,但不能引入新杂质,故答案为:氧化铜、氢氧化铜、碳酸铜、碱式碳酸铜;
(4)稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH变化大的酸性较强,所以HA的酸性强,表示HF的稀释过程的曲线是HB;故答案为:HB;
(5)(NH4 )2SO4是强酸弱碱盐,NH4+水解显酸性,水解的离子方程式为NH4+ + H2O![]() NH3·H2O+H+,故答案为:NH4+ + H2O
NH3·H2O+H+,故答案为:NH4+ + H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(6)酸性越强,pH越小,四种混合物中,②NH4Cl与HCl的pH最小,④NH4Cl与NH3·H2O的pH最大,①NH4Cl与 CH3COONa显中性,③NH4Cl与NaCl显酸性,故pH大小关系为:②<③<①<④,c(H+)=10-PH,c(H+)越大,pH越小,故c(H+)由小到大的顺序为④< ①< ③< ②,故答案为:④< ①< ③< ②;
(7)Zn与稀H2SO4反应中滴加几滴CuSO4溶液,能置换出一定量的铜,在溶液中形成
形成锌—铜—稀硫酸原电池,加快反应速率,故答案为: 形成锌—铜—稀硫酸原电池,加快反应速率。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
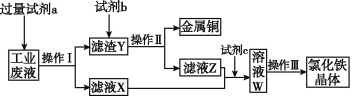
则下列说法正确的是
A. 试剂a是铁,试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C. 试剂c是氯气,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
D. 用KSCN溶液可检验溶液W中是否有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以石墨和过渡金属氧化物做电极材料、以固态有机高聚物做电解质溶剂的锂离子电池,放电时的 总反应方程式为:Li(1-x)CoO2+LixC6=LiCoO2+C6(x<1),其工作原理如图1所示,图2是合成有机高聚物的单体的结构简式。下列说法中,正确的是


A. 放电时,外电路电子由金属氧化物电极流向石墨电极
B. 充电时,石墨电极作阳极,过渡金属氧化物作阴极
C. 放电时负极反应为:LiC6-xe-=Li(1-x)C6+xLi+
D. 图2所示的两种单体可通过缩聚反应生成有机高聚物溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
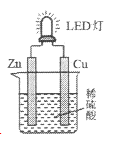
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。下列判断不正确的是( )

A. 原上层液体可能是KI的水溶液,原下层液体可能是CCl4
B. 搅拌后两层液体颜色发生变化的原因是I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
C. 阴极区域pH增大的原因是水分子得电子生成了OH—
D. 阳极上的电极反应式2H++2e - =H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如图所示,下列叙述不正确的是
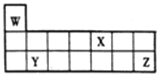
A. 原子半径:Y>Z>W
B. Z的氧化物对应的水化物酸性均比X的强
C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气(含烃类、CO、NO和SO2等)是空气的主要污染源。治理方法之一是在汽车排气管上加装“催化转化器”,使CO和NO反应产生可参与大气循环的无毒气体,促使烃类充分燃烧及SO2的转化。下列说法中错误的是
A. CO和NO反应生成CO2和N2:2CO+2NO![]() 2CO2+N2
2CO2+N2
B. 汽车改用天然气为燃料或开发氢能源,都可减少对空气的污染
C. 此方法的缺点是由于CO2的增多,会大大提高空气的酸度
D. 增大绿化面积,多植树造林,可有效控制城市空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理(平衡移动原理)解释的是
A. 对于反应体系 CO(g) + NO2(g) ![]() NO(g) + CO2(g),压缩体积可使颜色变深
NO(g) + CO2(g),压缩体积可使颜色变深
B. 实验室可用排饱和食盐水的方法收集氯气
C. 重铬酸钾溶液中存在如下平衡:Cr2O72-(橙红色)+H2O![]() 2H++2CrO42-(黄色),向K2Cr2O7溶液中加入几滴氢氧化钠,溶液变黄色
2H++2CrO42-(黄色),向K2Cr2O7溶液中加入几滴氢氧化钠,溶液变黄色
D. 开启啤酒瓶后,瓶中马上泛起大量泡沫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com