
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:实验题
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A-E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
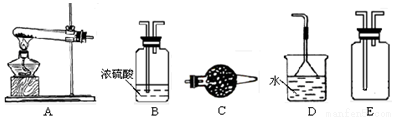
(1)实验空制取、收集干燥的NH3,需选用上述仪器装置中的 , 所用干燥剂的名称为 。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,写出制纳米级碳酸钙的化学方程式: 。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级(1nm-100nm之间): 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=14的溶液中:K+、NH4+、NO3-、HCO3-
B.澄清透明的溶液:Cu2+、Mg2+、SO42-、Cl-
C.0.1mol·L-1Fe(NO3)2溶液中:H+、Ca2+、SCN-、Cl-
D.c(Fe2+)=1.0 mol·L-1溶液:H+、K+、Cl-、MnO4-
查看答案和解析>>
科目:高中化学 来源:2016届广西柳州铁路第一中学高三上学期10月月考理化学试卷(解析版) 题型:选择题
某绝热恒容容器中充入2mol/L NO2,发生反应2NO2 N2O4 △H=﹣56.9kJ/mol下列分析不正确的是( )
N2O4 △H=﹣56.9kJ/mol下列分析不正确的是( )
A. 5s时NO2的转化率为75%
B. 0﹣3s时v(NO2)增大是由于体系温度升高
C. 3s时化学反应处于平衡状态
D. 9s时再充入N2O4,平衡后K较第一次平衡时大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:填空题
如下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
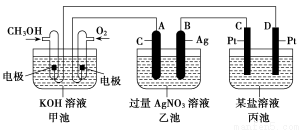
(1)甲池是________装置。
(2)乙池中A(石墨)电极的名称是________。
(3)写出通入CH3OH的电极的电极反应式:_________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________ mL(标准状况);此时丙池某电极上析出1.60 g某金属,则丙池中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源:2016届浙江宁波效实中学高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.10mL 18mol/L浓硫酸与足量铜加热充分反应,其中有0.09NA个H2SO4体现了氧化性
B.33.6LCl2一定能与56g铁在加热条件下发生反应
C.12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
D.在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有21NA个电子发生转移
查看答案和解析>>
科目:高中化学 来源:2016届陕西西安第一中学高三上学期期中考试化学试卷(解析版) 题型:选择题
利用下图所示装置进行下列实验,不能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A. | 浓盐酸 | KMnO4 | NABr溶液 | 氧化性:KMnO4> Cl2>Br2 | |
B. | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C. | 稀盐酸 | NA2SO3 | BA(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D. | 稀硫酸 | NA2CO3 | NA2SiO3溶液 | 酸性:硫酸>碳酸>硅酸 |
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高二上期中考试化学试卷卷(解析版) 题型:简答题
氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:N2(g)+3H2(g) NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
NH3(g)ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题:
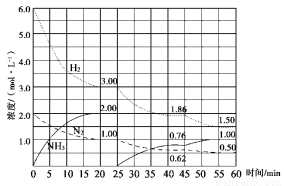
(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为 。
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是 。
(4)由第一次平衡到第二次平衡,平衡移动的方向是_______,采取的措施是________ 。
(5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图像。

查看答案和解析>>
科目:高中化学 来源:2016届山东省青岛市高三上学期期中测试化学试卷(解析版) 题型:选择题
已知NH4CuSO3与足量的10mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1mol NH4CuSO3完全反应转移0.5mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com