
| A、钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| B、与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| C、可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、NH3、HCl的水溶液都能导电,但NH3不是电解质 |
| B、Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、新制氯水和SO2都具有漂白性,都能使紫色石蕊试液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温下,1mol SO3含有的分子数为NA个 |
| B、0.1molAl3+离子含有核外电子数为NA个 |
| C、1molCl2与1mol Fe反应,转移电子为3 NA个 |
| D、标准状况下2.24L己烷含有分子数目为0.1 NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、32 g O2所含的氧原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
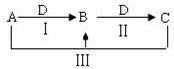 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
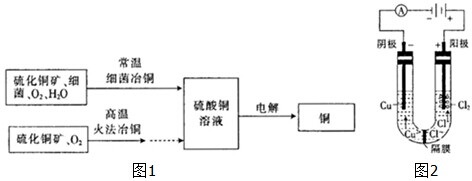
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com