
A、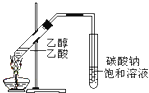 制备乙酸乙酯 制备乙酸乙酯 |
B、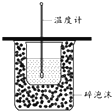 测定中和热 |
C、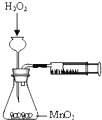 测定反应速率 |
D、 分离溴乙烷和水 |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、元素的非金属性越强,单质的活泼性一定越强 |
| B、分子晶体中分子间的作用力越大,分子越稳定 |
| C、离子晶体发生状态变化时,一定会破坏离子键 |
| D、分子中含有两个氢原子的酸,一定就是二元酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2与H2O的反应:Cl2+H2O=2H++Cl-+ClO- |
| B、FeCl3溶液与KI溶液跑反应:Fe3++2I-=Fe2++I2 |
| C、Cu与稀硝酸的反应:Cu+2H++NO3-=Cu2++NO↑+H2O |
| D、Al2O3与NaOH溶液的反应:Al2O3+2OH-+3H2O=2[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:
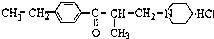 盐酸乙哌立松片是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧张状况,其结构筒式如图:关于盐酸乙哌立松片有下列说法其中正确的是( )
盐酸乙哌立松片是一种骨骼肌松弛剂,能改善由肩周炎、腰痛症等引起的肌紧张状况,其结构筒式如图:关于盐酸乙哌立松片有下列说法其中正确的是( )| A、①③④ | B、①②③ |
| C、①②④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3 |
| B、NaHSO4 |
| C、Na2CO3 |
| D、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| B、与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| C、可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| D、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水晶项链和卫生间地面的瓷砖都是硅酸盐制品 |
| B、用纯铝制造的高压锅更耐用 |
| C、玻璃是混合物,没有固定的熔点 |
| D、聚乙烯是热固性塑料,可用于制造电源插座 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取10.50g的干燥的NaC1固体 |
| B、蒸馏时温度计水银球应插入混合液中且不与烧瓶底部接触 |
| C、配制浓硫酸和浓硝酸的混酸时,应将浓硫酸慢慢加到浓硝酸中,及时搅拌和冷却 |
| D、测溶液的pH需先用蒸馏水润湿pH试纸,再用干燥洁净的玻璃棒蘸溶液滴在试纸上,并与标准比色卡对照 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com