
6.5g锌和100mL2mol/L稀硫酸完全反应,反应后溶液的体积仍为100mL。求:
(1)在标准状况下,生成气体的体积;
(2)生成物的物质的量浓度;
(3)反应后的溶液中SO 的物质的量浓度;
的物质的量浓度;
(4)在反应后的溶液中加入1mol/L氢氧化钾溶液,恰好使其中的金属离子完全沉淀时,需加入氢氧化钾溶液的体积。
(1)2.24L (2)1mol/L (3)2mol/L (4)400mL
解析试题分析:H2SO4 + Zn = ZnSO4 + H2↑
65 g 1mol 22.4L
6.5g 0.1c ﹙ ZnSO4﹚ V(H2)
65 g÷ 6.5g =1mol÷0.1c ﹙ ZnSO4﹚ 65 g÷ 6.5g = 22.4L÷ V(H2)
c ﹙ ZnSO4﹚=1mol/L V(H2)=2.24L
(1)产生的气体在标准状况下的体积为2.24L;(2)反应完全后,所得溶液中硫酸锌的物质的量浓度为1mol/L;(3)反应前后SO42-的物质的量没有变化,溶液的体积也未发生变化,故SO42-的浓度不变,仍为2mol/L;(4)反应后溶液中剩余0.1mol的硫酸和0.1mol的硫酸锌,在反应后的溶液中加入1mol/L氢氧化钾溶液,氢氧化钾溶液分别和硫酸、硫酸锌溶液反应,恰好使金属离子完全沉淀时,需氢氧化钾0.4mol,需氢氧化钾的体积为0.4mol/(1mol/L)=0.4L=400mL。
考点:物质的量浓度的相关计算


科目:高中化学 来源: 题型:填空题
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”溶液中含有的成分,阅读后回答下列问题:
| 成分 | 质量(g) | 摩尔质量(g ·mol—1) |
| 蔗糖 | 25.0 | 342 |
| 硫酸钾 | 0.3 | 174 |
| 阿司匹林 | 0.2 | 180 |
| 高锰酸钾 | 0.3 | 158 |
| 硝酸银 | 0.1 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将6.4 g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余。试计算:(要求有计算过程)
(1)生成的SO2的体积(标准状况下)。
(2)若用4 mol·L-1的NaOH溶液吸收生成的SO2 ,恰好生成Na2SO3 ,计算需要NaOH溶液的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在标准状况下,将44.8LHCl溶于927mL水(密度为1g/cm3)中,所得盐酸的密度为1.05g/cm3,计算所得盐酸的溶质质量分数及物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
把2.0 mol/L CuSO4溶液和1.0 mol/LH2SO4溶液各100 mL混合(假设混合后溶液的体积等于混合前两种溶液的体积之和)。计算:
(1)混合液中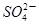 的物质的量浓度_____________mol/L;
的物质的量浓度_____________mol/L;
(2)向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余。此时,生成气体的体积(标准状况)为_________________L,溶液中Fe2+的物质的量浓度是___________mol/L;
(3)向混合溶液中滴加1 mol/L的NaOH溶液,使Cu2+恰好完全沉淀,所需NaOH溶液的体积_____________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
有一瓶100ml硫酸和硝酸的混合溶液,取出10.00ml该混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,得4.66g沉淀。滤液跟2.00mol/L的NaOH溶液反应共用去35.00mlNaOH溶液时恰好使溶液呈中性,则混合酸中硫酸和硝酸的物质的量的浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
硫酸是重要的化工产品,在基础化学实验中,有着重要的作用。
(1)物质的量浓度为18.4mol/L,质量分数为0.98的浓硫酸吸收水蒸气时,当其质量分数下降到0.87(密度1.8g?cm-3)以下时,则失去干燥能力。 质量分数为0.87的硫酸的物质的量浓度为
(保留两位小数,下同)。50mL 18.4mol/L的浓硫酸作为干燥剂时,最多可吸水___________g。
(2)工业上以高岭土和硫酸.氨气为原料制取铵明矾[NH4Al(SO4)2·12H2O]和硫酸铝,反应原理如下(忽略高岭土其他成分与硫酸的反应):
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O…………①
Al2(SO4)3 + H2SO4 + 2NH3 → 2NH4Al(SO4)2…………②
某工厂欲同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时氧化铝和硫酸的物质的量之比是
(3)硫酸工业上大多用接触法制硫酸(设空气中氧气的体积分数为20%),为使黄铁矿煅烧充分,常通入过量40%的空气,则煅烧后炉气中SO2的体积分数为_____。
(4)将上述炉气经净化除尘后直接送入接触室,气体体积减少了5%(同温同压下测定),试计算SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某次实验需用0.4 mol/L NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;用少量蒸馏水洗涤烧杯 次,洗涤后的溶液一并转入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;向容量瓶中加入蒸馏水,到液面_____________________时,改用__________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀;若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
| A.所用的NaOH中混有少量Na2O |
| B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥 |
| C.配制溶液所用的容量瓶洗净后没有烘干 |
| D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com