
【题目】一真空定容的密闭容器中盛有1mol PCl5,发生反应PCl5(g) ![]() PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入0.5mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是
PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入0.5mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是
A. M>N B. M=N C. M<N D. 无法比较
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和化学平衡影响的图象,其中图象和实验结论表达错误的是




A. a是其他条件一定时,反应速率随温度变化的图象,正反应ΔH > 0
B. b是在有无催化剂存在下建立的平衡过程图象,Ⅰ是使用催化剂时的曲线
C. c是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1 > p2
D. d是在平衡体系的溶液中溶入少量KCl固体后化学反应速率随时间变化的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3·6H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3·6H2O。下列实验原理和装置不能达到实验目的的是
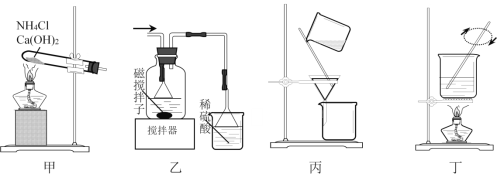
A. 用装置甲制备NH3
B. 用装置乙制备Cu(NH3)4Cl2并沉铁
C. 用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3
D. 用装置丁将FeCl3溶液蒸干制备FeCl3·6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g) ![]() 2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化

试回答:
(1)写出下列物质的化学式:B的化学式_____________,C的化学式________________,D的化学式_____________,H的化学式________________。
(2)写出由E转变成F的化学方程式:_______________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式__________________________________;向G溶液加入A的有关离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种非金属元素(除H外),A、B在反应中各结合1个电子,形成稳定结构,与氢气化合产物的稳定性,B>A;原子序数C>D,C、D的稳定结构的核外电子数与A的稳定结构的核外电子数相等,则四种元素的非金属性由强到弱的排列顺序正确的是( )
A.A、B、D、CB.B、A、D、CC.A、B、C、DD.B、A、C、D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1) O2和O3是氧元素的两种单质。根据分子式回答。
等质量的O2和O3的物质的量之比为________,所含分子数之比为________,原子个数比为____________。
(2) NO2和N2O4是氮元素的两种常见氧化物,常温下都是气体,它们之间在常温下就能相互转化,因而经常见到的是两种气体的混合物。现取46 g该气体,所含氮原子的物质的量为________,所含氧原子个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理烟气中SO2常采用两种方法:液吸法和还原法。
Ⅰ.碱液吸收法
25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。第1步:用过量的浓氨水吸收SO2,并在空气中氧化;第2步:加入石灰水,发生反应Ca2++2OH-+2NH4+ +SO42-![]() CaSO4↓+2NH3·H2O K。
CaSO4↓+2NH3·H2O K。
(1)25 ℃时,0.1 mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。
(2)计算第2步中反应的K=___________。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)![]() S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1,②2H2(g)+SO2(g)
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1,②2H2(g)+SO2(g)![]() S(l)+2H2O(g) ΔH2=+45.4 kJ/mol,③CO的燃烧热ΔH3=-283 kJ/mol。
S(l)+2H2O(g) ΔH2=+45.4 kJ/mol,③CO的燃烧热ΔH3=-283 kJ/mol。
(3)表示液态硫(S)的燃烧热的热化学方程式为_____________。
(4)反应②中,正反应活化能E1____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[![]() =y]、温度T的关系如图所示。
=y]、温度T的关系如图所示。

比较平衡时CO的转化率α(CO):N____(填“>”“<”或“=”,下同)M。逆反应速率:N___P。
(6)某温度下,向10 L恒容密闭容器中充入2 mol H2、2 mol CO和2 mol SO2发生反应①、②,第5 min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为________。
②其他条件不变,在第7 min时缩小容器体积,α(SO2)______(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com