
【题目】已知有以下物质相互转化

试回答:
(1)写出下列物质的化学式:B的化学式_____________,C的化学式________________,D的化学式_____________,H的化学式________________。
(2)写出由E转变成F的化学方程式:_______________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式__________________________________;向G溶液加入A的有关离子方程式____________________________________________。
【答案】FeCl2 KOH KCl AgCl 4Fe(OH)2+O2+2H2O==4 Fe(OH)3 Fe3++3SCN-==Fe(SCN)3 2 Fe3++Fe==3 Fe2+
【解析】
由转化可知,白色沉淀E为Fe(OH)2,红褐色沉淀F为Fe(OH)3,D溶液加入硝酸酸化的硝酸银生成白色沉淀H为AgCl,生成的溶液中含有钾离子,证明D溶液为KCl,由元素守恒可知,C为KOH,F溶解于盐酸,说明加盐酸溶解生成的G为FeCl3,可知A为Fe,B为FeCl2,以此来解答。
由转化可知,白色沉淀E为Fe(OH)2,红褐色沉淀F为Fe(OH)3,D溶液加入硝酸酸化的硝酸银生成白色沉淀H为AgCl,生成的溶液中含有钾离子,证明D溶液为KCl,由元素守恒可知,C为KOH,F溶解于盐酸,说明加盐酸溶解生成的G为FeCl3,可知A为Fe,B为FeCl2;
(1)由上述分析可知,B、C、D、H分别为FeCl2、KOH、KCl和AgCl;
(2)由E转变成F的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)三价铁离子和硫氰酸根离子形成血红色溶液,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3或Fe3++SCN-=Fe(SCN)2+,向G溶液加入A的有关反应的离子方程式为2Fe3++Fe=3Fe2+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
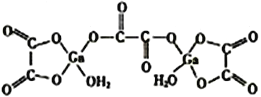
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
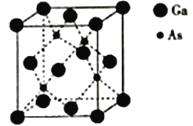
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/ (mol·L-1) | 0.44 | 0.6 | 0.6 |
(1)比较此时正.逆反应速率的大小:v正_______v逆(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)=___________;该时间内反应速率v(CH3OH)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一真空定容的密闭容器中盛有1mol PCl5,发生反应PCl5(g) ![]() PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入0.5mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是
PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入0.5mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是
A. M>N B. M=N C. M<N D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的说法不正确的是( )
A.燃料电池属于二次电池
B.铜锌原电池工作时,电流沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4P(红磷s) ![]() P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
A.当lmol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com