
【题目】目前,处理烟气中SO2常采用两种方法:液吸法和还原法。
Ⅰ.碱液吸收法
25 ℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。第1步:用过量的浓氨水吸收SO2,并在空气中氧化;第2步:加入石灰水,发生反应Ca2++2OH-+2NH4+ +SO42-![]() CaSO4↓+2NH3·H2O K。
CaSO4↓+2NH3·H2O K。
(1)25 ℃时,0.1 mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。
(2)计算第2步中反应的K=___________。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)![]() S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1,②2H2(g)+SO2(g)
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1,②2H2(g)+SO2(g)![]() S(l)+2H2O(g) ΔH2=+45.4 kJ/mol,③CO的燃烧热ΔH3=-283 kJ/mol。
S(l)+2H2O(g) ΔH2=+45.4 kJ/mol,③CO的燃烧热ΔH3=-283 kJ/mol。
(3)表示液态硫(S)的燃烧热的热化学方程式为_____________。
(4)反应②中,正反应活化能E1____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[![]() =y]、温度T的关系如图所示。
=y]、温度T的关系如图所示。

比较平衡时CO的转化率α(CO):N____(填“>”“<”或“=”,下同)M。逆反应速率:N___P。
(6)某温度下,向10 L恒容密闭容器中充入2 mol H2、2 mol CO和2 mol SO2发生反应①、②,第5 min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为________。
②其他条件不变,在第7 min时缩小容器体积,α(SO2)______(填“增大”“减小”或“不变”)。
【答案】> 4.3×1013 S(l)+O2(g)=SO2(g) ΔH=-529kJ/mol > > < 2700 增大
【解析】
(1)由于Kb(NH3H2O)=1.8×10-5>Ka2(H2SO3)=1.0×10-7,由盐的水解规律:“谁弱谁水解,谁强显谁性”可知,(NH4)2SO3溶液呈碱性,pH>7;
(2)第2步:加入石灰水,发生反应Ca2++2OH-+2NH4+ +SO42-![]() CaSO4↓+2NH3·H2O 化学平衡常数K=
CaSO4↓+2NH3·H2O 化学平衡常数K=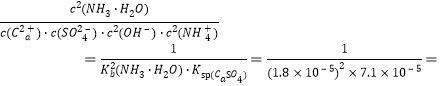 4.3×1013;
4.3×1013;
(3)①2CO(g)+SO2(g)![]() S(l)+2CO2(g)△H1=-37.0kJ/mol,
S(l)+2CO2(g)△H1=-37.0kJ/mol,
②2H2(g)+SO2(g)=S(l)+2H2O(g) △H2=+45.4kJ/mol,
CO的燃烧热△H3=-283kJ/mol,即③CO(g)+![]() O2(g)=CO2(g) △H3=-283kJ/mol,③×2-①,S(l)+O2(g)=SO2(g) △H=2△H3-△H1=-529kJ/mol;
O2(g)=CO2(g) △H3=-283kJ/mol,③×2-①,S(l)+O2(g)=SO2(g) △H=2△H3-△H1=-529kJ/mol;
(4)反应②的正反应为吸热反应,正反应活化能E1-E2=ΔH2>0,E1=E2+ΔH2,由于E2>0,所以E1>ΔH2;
(5)分析图象,当控制物料比相同时,T1温度下的转化率高于T2温度下的转化率,考虑到反应是吸热反应,温度升高有利于提高反应物的转化率,则温度关系应为:T1>T2;
①N点和M点时SO2的转化率相同,温度M点高于N点,升高温度有利于提高转化率,同时对于反应①来说,增加其中一种反应物的量可使另一反应物的转化率提高,而该物质本身的转化率降低,转化率已经可以由温度控制,为使二者SO2转化率相等,则需要控制N点CO的量少于M点CO的量,则转化率:N>M;
②温度T1>T2,温度越高,化学反应速率越大,则逆反应速率:N<P;
(6)① 对于2CO(g)+SO2(g)![]() S(l)+2CO2(g)
S(l)+2CO2(g)
c(开始) 0.2 0.2 0
c(平衡) 0.04 0.12 0.16
对于反应2H2(g)+SO2(g)![]() S(l)+2H2O(g)
S(l)+2H2O(g)
c(开始) 0.2 0.12 0
c(平衡) 0.02 0.03 0.18
所以反应②的化学平衡常数K=![]()
②其他条件不变,在第7 min时缩小容器体积,也就使容器的压强增大,由于两个反应的正反应都是气体体积减小的反应,所以缩小体积,容器的压强增大,化学平衡正向移动,α(SO2)增大。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】一真空定容的密闭容器中盛有1mol PCl5,发生反应PCl5(g) ![]() PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入0.5mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是
PCl3(g)+Cl2(g),一定条件下平衡时PCl5所占的体积百分数为M,若相同条件相同容器中,最初放入0.5mol PCl5,则平衡时,PCl5的体积百分数为N,下列结论正确的是
A. M>N B. M=N C. M<N D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有pH=3的HCl溶液100 mL,要使它的pH=4,如果加入蒸馏水,需加水_____ mL (假定溶液体积有加和性,下同)。
(2)常温下,将pH=8的NaOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH=_______。
(3)今有A.盐酸 B.醋酸 C.硫酸三种酸:
①在同体积、同浓度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是______________.(填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系是__________,反应所用时间长短关系是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4P(红磷s) ![]() P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
P4(白磷s);△H=+17kJ·mol-1根据以上方程式,下列推论正确的是
A.当lmol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明氯化氢是共价化合物的现象是
A.氯化氢极易溶于水 B.液态氯化氢不能导电
C.氯化氢在水溶液中完全电离 D.氯化氢是无色有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
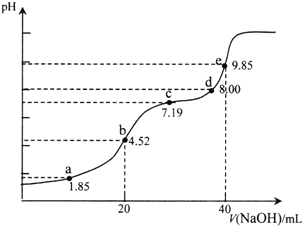
A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:

己知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS 、CuO和SiO2等);
II.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29
回答下列问题:
(1)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是________(填化学式)。
(2)写出“还原”反应的化学方程式:______________ 。
(3)已知:浸出液中:c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______(填化学式);当CuS、PbS共沉时,![]() =_________。加入硫化钠的量不宜过多,原因是_________。
=_________。加入硫化钠的量不宜过多,原因是_________。
(4)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂、还原剂的物质的量之比___________。
(5)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于反应2HI(g) ![]() H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com