
【题目】下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH![]() 、Cl-、HS-
、Cl-、HS-
B.酸性溶液中可能大量存在Na+、CH3COO-、SO![]() 、I-
、I-
C.碱性溶液中可能大量存在Na+、K+、Cl-、AlO![]()
D.使甲基橙变黄色的溶液中可能大量存在Fe3+、K+、Cl-、SO![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,正确的是( )

A.常温下水很稳定(1000℃以上才会部分分解),因为水中含有大量氢键
B.![]() 该分子含有1个手性碳原子
该分子含有1个手性碳原子
C.含有极性键的分子一定是极性分子
D.由图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到相应目的的是( )
目的 | A.验证牺牲阳极的阴极保护法 | B.研究浓度对FeCl3水解平衡的影响 |
实验方案 |
|
|
目的 | C.比较CH3COOH和H3BO3(硼酸)酸性的强弱 | D.比较AgCl和AgI溶解度的大小 |
实验方案 |
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂可用于氮的固定,其转化过程如图所示。下列说法错误的是
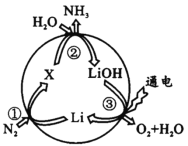
A.反应①中N2是氧化剂
B.反应②属于复分解反应
C.转化过程中涉及的H2O、LiOH都属于电解质
D.反应③中Li在阳极生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、食品工业等行业。
(1)市售碳酸钠中含有氯化钠杂质,选用下列试剂设计实验方案进行检验,试剂:稀H2 SO4、BaCl2溶液、Ca(NO3)2溶液、AgNO3溶液
实验步骤 | 现 象 |
①取少量样品,加蒸馏水溶解 | ②固体完全溶解得到无色澄清溶液 |
③_____ | ④有白色沉淀生成 |
⑤静置,________ | ⑥ ________ |
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用____加蒸馏水至刻度线。
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用____取500 mL水并倒入烧杯中,搅拌摇匀后,转入____色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L。
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,滴定终点的现象为_________。
重复上述操作三次。四次测定数据如下表:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液体积/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
若在滴定终点读取滴定管刻度时俯视标准液液面,则测定结果____(填“偏高”、“偏低”或“无影响”);样品的纯度为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、OH-、Na+、K+、NO![]() ,加入铝粉后,只产生H2,为探究该溶液中存在的离子,某学习小组进行了如下实验。
,加入铝粉后,只产生H2,为探究该溶液中存在的离子,某学习小组进行了如下实验。
(1)甲同学分析“若H+大量存在,则NO![]() 就不能大量存在”,设计实验证实如下:
就不能大量存在”,设计实验证实如下:
装置 | 现象 |
| Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,液面上方出现浅棕色气体 Ⅲ.试管变热,溶液沸腾 |
①现象Ⅲ产生的原因___。
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实验 | 内容 | 现象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 试纸未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
实验1、2说明反应生成了NO。
请用化学方程式解释气体变为浅棕色的原因___。
(2)乙同学分析“若OH-大量存在,NO![]() 也可能不大量存在”,重新设计实验证实如下:
也可能不大量存在”,重新设计实验证实如下:
装置 | 现象 |
| Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,有刺激性气味 |
为确认:"刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
产生该刺激性气味气体的离子方程式是___。
(3)甲、乙两位同学设计的实验初始时均未见明显现象的原因是___。
(4)根据以上实验分析,该溶液中一定大量存在的离子是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
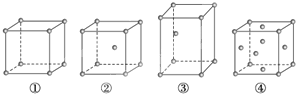
A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的结构简式。
(1)2,3二甲基戊烷_________;
(2)2,3二甲基1丁烯____________;
用系统命名法命名下列有机物。
(3)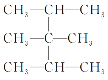 :___________
:___________
(4)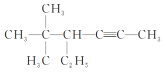 :___________
:___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com