
【题目】碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、食品工业等行业。
(1)市售碳酸钠中含有氯化钠杂质,选用下列试剂设计实验方案进行检验,试剂:稀H2 SO4、BaCl2溶液、Ca(NO3)2溶液、AgNO3溶液
实验步骤 | 现 象 |
①取少量样品,加蒸馏水溶解 | ②固体完全溶解得到无色澄清溶液 |
③_____ | ④有白色沉淀生成 |
⑤静置,________ | ⑥ ________ |
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用____加蒸馏水至刻度线。
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用____取500 mL水并倒入烧杯中,搅拌摇匀后,转入____色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L。
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,滴定终点的现象为_________。
重复上述操作三次。四次测定数据如下表:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液体积/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
若在滴定终点读取滴定管刻度时俯视标准液液面,则测定结果____(填“偏高”、“偏低”或“无影响”);样品的纯度为____%。
【答案】加入过量 Ca(NO3)2溶液 取上层清液, 滴入AgNO3溶液 有白色沉淀生成 胶头滴管 量筒 棕 滴入最后一滴 AgNO3 标准溶液, 出现砖红色沉淀, 且半分钟内颜色不复原 偏高 ![]()
【解析】
(1)市售碳酸钠中含有氯化钠杂质,要检验氯化钠杂质可以检验是否含有氯离子即可,检验之前需要先排除碳酸根离子的干扰,据此分析解答;
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。滴定过程的原理为Ag++Cl-=AgCl↓,当溶液中的氯离子滴定结束时,硝酸银和K2CrO4会反应生成砖红色的Ag2CrO4沉淀,据此分析解答。
(1)市售碳酸钠中含有氯化钠杂质,要检验氯化钠杂质可以检验是否含有氯离子即可,检验之前需要先排除碳酸根离子的干扰,实验方案为:取少量样品,加蒸馏水溶解,固体完全溶解得到无色澄清溶液;加入过量 Ca(NO3)2溶液,有白色碳酸钙沉淀生成;取上层清液, 滴入AgNO3溶液,有白色氯化银沉淀生成,故答案为:加入过量 Ca(NO3)2溶液;取上层清液, 滴入AgNO3溶液;有白色沉淀生成;
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用胶头滴管加蒸馏水至刻度线,故答案为:胶头滴管;
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用量筒取500 mL水并倒入烧杯中,AgNO3见光容易分解,搅拌摇匀后,转入棕色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L,故答案为:量筒;棕;
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,氯化银为白色沉淀,Ag2CrO4为砖红色沉淀,因此滴定终点的现象为滴入最后一滴 AgNO3 标准溶液, 出现砖红色沉淀, 且半分钟内颜色不复原;根据四次测定数据,第2次的实验数据偏差较大,删除,其余3次实验数据的平均值为![]() =20.00 mL,滴定过程的原理为Ag++Cl-=AgCl↓,消耗AgNO3的物质的量=0.02L×b mol/L=0.02bmol,则原溶液中氯离子的物质的量=0.02bmol×
=20.00 mL,滴定过程的原理为Ag++Cl-=AgCl↓,消耗AgNO3的物质的量=0.02L×b mol/L=0.02bmol,则原溶液中氯离子的物质的量=0.02bmol×![]() =0.1bmol,样品中氯化钠的含量为
=0.1bmol,样品中氯化钠的含量为![]() ×100%=
×100%=![]() %,则样品的纯度为1-
%,则样品的纯度为1-![]() %=
%=![]() %,若在滴定终点读取滴定管刻度时俯视标准液液面,会导致读取的AgNO3溶液体积偏小,测得的样品中氯化钠的含量偏低,样品的纯度偏高,故答案为:滴入最后一滴 AgNO3 标准溶液, 出现砖红色沉淀, 且半分钟内颜色不复原;偏高;
%,若在滴定终点读取滴定管刻度时俯视标准液液面,会导致读取的AgNO3溶液体积偏小,测得的样品中氯化钠的含量偏低,样品的纯度偏高,故答案为:滴入最后一滴 AgNO3 标准溶液, 出现砖红色沉淀, 且半分钟内颜色不复原;偏高;![]() 。
。


科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体。以A和B为原料合成扁桃酸衍生物F的路线如图:
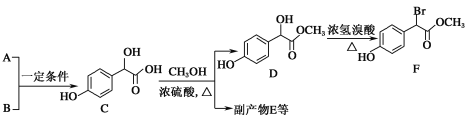
(1)A分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为__。B分子式为C6H6O,写出A+B→C的化学反应方程式:__。
(2)C(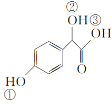 )中①、②、③3个—OH的酸性由强到弱的顺序是__。
)中①、②、③3个—OH的酸性由强到弱的顺序是__。
(3)1molF在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为__mol。符合下列条件的F的同分异构体(不考虑立体异构)共有___种。
①能与碳酸氢钠溶液反应②苯环上只有2个取代基,其中一个是羟基
(4)已知:R—CH2—COOH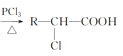 ,A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)___。
,A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选)___。
合成路线流程图示例如下:H2C=CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5
CH3COOC2H5

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。
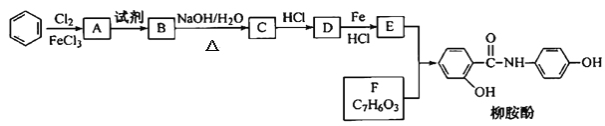
已知:①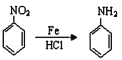
②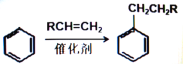 (R为烃基或H原子)
(R为烃基或H原子)
回答下列问题:
(1)对于柳胺酚,下列说法正确的是___(填序号)。
A.1mol柳胺酚最多可以和2molNaOH反应
B.不能发生硝化反应
C.可发生水解反应
D.可与溴发生取代反应
(2)写出A→B反应所需的试剂___。
(3)写出B→C的化学方程式___。
(4)写出化合物F的结构简式____。
(5)写出同时符合下列条件的F的同分异构体的结构简式___(写出1种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线___(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的鉴别或检验错误的是
A.用激光笔照射区别食盐水和蛋白质溶液
B.向溶液中滴入铁氰化钾溶液,可检验溶液中是否存在Fe2+
C.将红色石蕊试纸伸到集气瓶口可检验瓶里是不是氨气
D.向溶液中滴入足量稀盐酸后再滴入氯化钡溶液,可检验溶液中是否存在SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用活性炭还原氮氧化物可防止空气污染。向1L密闭容器加入一定量的活性炭和NO,某温度下发生反应:
已知:①C(s)+2NO(g)![]() N2(g)+CO2 (g) ΔH
N2(g)+CO2 (g) ΔH
②C(s)+O2(g)![]() CO2 (g) ΔH1= -393.5 kJ/mol
CO2 (g) ΔH1= -393.5 kJ/mol
③N2(g)+O2(g)![]() 2NO(g) ΔH2= +180.5 kJ/mol
2NO(g) ΔH2= +180.5 kJ/mol
下列说法错误的是
A.ΔH= -574.0 kJ/mol
B.当容器内气体密度不变时,反应①达到平衡状态
C.反应③正反应的活化能大于180.5 kJ/mol
D.反应①达到平衡后,增大压强平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH![]() 、Cl-、HS-
、Cl-、HS-
B.酸性溶液中可能大量存在Na+、CH3COO-、SO![]() 、I-
、I-
C.碱性溶液中可能大量存在Na+、K+、Cl-、AlO![]()
D.使甲基橙变黄色的溶液中可能大量存在Fe3+、K+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列说法中正确的是
A.室温下,盐酸中c(Cl-)与醋酸溶液中c(CH3COO-)相等,则两溶液的pH相等
B.将amol·L-1的醋酸溶液与0.01mol·L-1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO-),则醋酸的电离常数K=![]() (用含a的代数式表示)
(用含a的代数式表示)
C.向NH4Cl溶液中加入少量等物质的量浓度的稀盐酸,则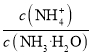 的值减小
的值减小
D.向Na[Al(OH)4]溶液中逐滴加入稀盐酸至沉淀恰好消失时:c(Cl-)=3c(Al3+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、已知:SiHCl3在催化剂作用下可发生如下反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48kJ·mol1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=30kJ·mol1
(1)写出由SiHCl3(g)分解产生SiH4(g)和SiCl4(g)的热化学方程式为__。
Ⅱ、298K时,溶液中存在如下反应:A(aq)![]() B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
t/min | 0 | 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
c/(mol·L-1) | 0 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
回答下列问题:
(2)该反应在50~80min内的平均反应速率为__mol·L1·min1。
(3)120min时A的转化率为__。
(4)298K时,该反应的平衡常数K=__,升温时平衡常数__(填“增大”、“减小”、或“不变”)。
(5)为提高A的平衡转化率,除适当控制反应温度外,还可采取的措施是__。
(6)下列叙述可说明可逆反应已达平衡的是__。
A.c(A)=c(B)
B.A和B反应速率相等
C.A和B的物质的量比值保持恒定
D.溶液的总质量保持恒定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.在NH4Al(SO4)2溶液中滴加少量烧碱溶液:Al3++4OH-=![]() +2H2O
+2H2O
B.在含等物质的量浓度的Na2CO3和NaOH溶液中滴加过量的盐酸:![]() +OH-+2H+=
+OH-+2H+=![]() +H2O
+H2O
C.在Mg(HCO3)2溶液中滴加过量的澄清石灰水:Mg2++2![]() +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
D.在Fe(NO3)2稀溶液中滴加少量NaHSO4溶液:Fe2++![]() +2H+=Fe3++NO2↑+H2O
+2H+=Fe3++NO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com