
����Ŀ���û���̿��ԭ��������ɷ�ֹ������Ⱦ����1L�ܱ���������һ�����Ļ���̿��NO��ij�¶��·�����Ӧ��
��֪����C(s)+2NO(g)![]() N2(g)+CO2 (g) ��H
N2(g)+CO2 (g) ��H
��C(s)+O2(g)![]() CO2 (g) ��H1= -393.5 kJ/mol
CO2 (g) ��H1= -393.5 kJ/mol
��N2(g)+O2(g)![]() 2NO(g) ��H2= +180.5 kJ/mol
2NO(g) ��H2= +180.5 kJ/mol
����˵���������
A.��H= -574.0 kJ/mol
B.�������������ܶȲ���ʱ����Ӧ�ٴﵽƽ��״̬
C.��Ӧ������Ӧ�Ļ�ܴ���180.5 kJ/mol
D.��Ӧ�ٴﵽƽ�������ѹǿƽ��������Ӧ�����ƶ�
���𰸡�D
��������
A����C(s)+O2(g)![]() CO2 (g) ��H1= -393.5 kJ/mol����N2(g)+O2(g)
CO2 (g) ��H1= -393.5 kJ/mol����N2(g)+O2(g)![]() 2NO(g) ��H2= +180.5 kJ/mol�����ݸ�˹���ɣ�����-�۵ã�C(s)+2NO(g)
2NO(g) ��H2= +180.5 kJ/mol�����ݸ�˹���ɣ�����-�۵ã�C(s)+2NO(g)![]() N2(g)+CO2 (g) ��H=(-393.5 kJ/mol)-(+180.5 kJ/mol)=-574.0 kJ/mol����A��ȷ��
N2(g)+CO2 (g) ��H=(-393.5 kJ/mol)-(+180.5 kJ/mol)=-574.0 kJ/mol����A��ȷ��
B��C(s)+2NO(g)![]() N2(g)+CO2 (g)����������������ķ�Ӧ���������������ܶȲ���ʱ��˵��������������䣬˵����Ӧ�ﵽ��ƽ��״̬����B��ȷ��
N2(g)+CO2 (g)����������������ķ�Ӧ���������������ܶȲ���ʱ��˵��������������䣬˵����Ӧ�ﵽ��ƽ��״̬����B��ȷ��
C����Ӧ���ʱ�=����Ӧ�Ļ��-�淴Ӧ�Ļ�ܣ���Ӧ��N2(g)+O2(g)![]() 2NO(g) ��H2= +180.5 kJ/mol��������Ӧ�Ļ�ܴ���180.5 kJ/mol����C��ȷ��
2NO(g) ��H2= +180.5 kJ/mol��������Ӧ�Ļ�ܴ���180.5 kJ/mol����C��ȷ��
D����Ӧ��C(s)+2NO(g)![]() N2(g)+CO2 (g)Ϊ��������ʵ�������ķ�Ӧ�������е������ѹǿʼ�ղ��䣬�ﵽƽ�������ѹǿƽ�ⲻ�ƶ�����D����
N2(g)+CO2 (g)Ϊ��������ʵ�������ķ�Ӧ�������е������ѹǿʼ�ղ��䣬�ﵽƽ�������ѹǿƽ�ⲻ�ƶ�����D����
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������軯�أ�K4[Fe(CN)6])�ֳƻ�Ѫ�Σ���һ����Ҫ�Ļ���ԭ�ϡ����������������ķ�ӦΪ��K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]��(������)+3KCl���ش����⣺
��1��д����̬Fe2+�ĺ�������Ų�ʽ__��
��2��K4[Fe(CN)6]�е������������ۼ��⣬����__��__��1molK4[Fe(CN)6]��������Ϊ__mol��
��3����Ѫ����Nԭ�ӵ��ӻ���ʽΪ__��C��N��O�ĵ�һ�������ɴ�С������Ϊ__���縺���ɴ�С������Ϊ__��
��4��Fe��Na��K�ľ���ṹ��ͼ��ʾ��
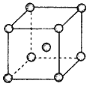
���Ƶ��۵�ȼظ��ߣ�ԭ����__��
��Feԭ�Ӱ뾶��rcm�������ӵ�����ΪNA���������ԭ������Ϊa���������ʵ��ܶ���__g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ͽ��۾���ȷ���ǣ� ��
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��ij�л�����������Ȼ�̼��Һ��� | ��Һ��ɫ | ���л����бض�����̼̼˫�� |
B | ������������Һ�еμ����ᱵ��ϡ���� | ������ɫ���� | ����������Һ�ѱ��� |
C | �����Ը��������Һ�еμ�˫��ˮ | ��ɫ��ȥ���������� | H2O2���л�ԭ�� |
D | ���Ҵ���Һ�м�һС���� | �������� | �Ҵ������ǻ� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������е�ʳƷ���Ӽ��а�ɰ�ǡ�������̼������ɫ�����ᡢ������ȡ����ֵ�����ζ�����ᣨ��ѧʽΪH3PO4���е���ѻӷ�����һ����ϵ��
(1)�����£����0.1mol/LH3PO4��Һ��pH=1.5���õ��뷽��ʽ����ԭ��__��
(2)���ڹ������ÿ��ֻ��ƻ������ʣ�ʹ�����ƽ�����ѿ����ƶ������ȣ�ݡ����ƽ���ƶ�ԭ������ԭ��__��
Ca5(PO4)3OH(s)![]() 5Ca2+(aq) +3PO
5Ca2+(aq) +3PO![]() (aq)+OH-(aq)
(aq)+OH-(aq)
(3)��������Һ�еμ�NaOH��Һ������������Һ�е����ʵ���������pH�Ĺ�ϵ��ͼ��ʾ��
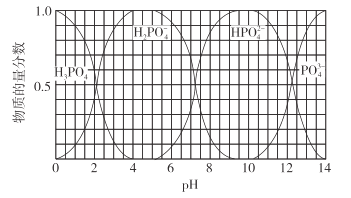
����������Һ�еμ�NaOH��Һ��pH=10ʱ��������Ҫ��Ӧ�����ӷ���ʽ��___��
�����й���0.1mol/LNa2HPO4��Һ��˵����ȷ����__������ţ���
a��Na2HPO4��Һ�Լ��ԣ�ԭ����HPO![]() ��ˮ��̶ȴ��������̶�
��ˮ��̶ȴ��������̶�
b��c(Na+)+c(H+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )+c(OH-)
)+c(OH-)
c��c(Na+)=c(H2PO![]() )+c(HPO
)+c(HPO![]() )+c(PO
)+c(PO![]() )+c(H3PO4)
)+c(H3PO4)
(4)С��ͬѧ��ʵ���Ҳⶨij����������ĺ����������ǰ�ɰ�ǡ��������Ӱ�죩��
i.��һƿ����ע��Բ����ƿ���������̿������ɫ�ء�
��.�����ֻ�������10min����ȴ�����£����ˡ�
��.ȡ50.00mL��Һ���ð������̪��ָʾ������0.100mol/LNaOH��Һ�ζ����յ�ʱ����Na2HPO4������NaOH��Һ5.00mL��
�����ȵ�Ŀ����__��
���ÿ�����Ʒ������ĺ���Ϊ__g/L��H3PO4Ħ������Ϊ98g/mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA�ǰ����ӵ�������ֵ������˵���������
A.1 L 0.1 mol/L NH4 NO3��Һ�к��е�ԭ������Ϊ0.2 NA
B.7.8 g Na2 O2��ˮ��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.2 NA
C.2.8 g CO��N2��������к���������Ϊ1.4 NA
D.��״���£�2. 24 L�������л�ѧ����ĿΪ0.9 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������Ҫ�Ļ���ԭ��֮һ���㷺Ӧ�����Ṥ�ջ������ġ�ʳƷ��ҵ����ҵ��
(1)����̼�����к����Ȼ������ʣ�ѡ�������Լ����ʵ�鷽�����м��飬�Լ���ϡH2 SO4��BaCl2��Һ��Ca(NO3)2��Һ��AgNO3��Һ
ʵ�鲽�� | �� �� |
��ȡ������Ʒ��������ˮ�ܽ� | �ڹ�����ȫ�ܽ�õ���ɫ������Һ |
��_____ | ���а�ɫ�������� |
�ݾ��ã�________ | �� ________ |
(2)��AgNO3����Һ�ζ�Cl-(��K2CrO4��ҺΪָʾ����Ag2CrO4Ϊש��ɫ����)�����ⶨ̼���ƵĴ��ȡ�
��������Ʒ��Һ����ȡij̼������Ʒmg��������ƿ����100 mL��Һ������ʱ����____������ˮ���̶��ߡ�
������AgNO3��Һ��Ũ�ȱ궨����ȡAgNO3����8.5 g���ձ��У���____ȡ500 mLˮ�������ձ��У�����ҡ�Ⱥ�ת��____ɫ�Լ�ƿ�����ڰ��������á���NaCl����Һ�궨����AgNO3��ҺŨ��Ϊb mol/L��
�۵ζ���Ʒ��ȡ��Ʒ��Һ20. 00 mL����ƿ�У��ӹ���ϡHNO3������2��3��K2 CrO4��Һ����AgNO3����Һ�ζ����ζ��յ������Ϊ_________��
�ظ������������Ρ��Ĵβⶨ�������±���
ʵ����� | 1 | 2 | 3 | 4 |
����AgNO3��Һ���/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
���ڵζ��յ��ȡ�ζ��̶ܿ�ʱ���ӱ�ҺҺ�棬��ⶨ���____(����ƫ��������ƫ����������Ӱ����)����Ʒ�Ĵ���Ϊ____%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����Ӧ����������ӷ���ʽ����ȷ���ǣ� ��
���� | ���� | ���ӷ���ʽ | |
A | ����̼������Һ��ͨ�����CO2 | �����Ա仯 | CO |
B | ���մ���Һ��Һ�еμ�ϡ���� | ������������ | CO |
C | ��Ba(OH)2��Һ�м�����NaHCO3��Һ | ���ɰ�ɫ���� | 2HCO |
D | ��NaHCO3��Һ�м�������ƫ������ | ���ɰ�ɫ��������ɫ���� | HCO |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫֲ��걾�ô���ͭ��(CH3COO)2Cu�ݴ�������ɫ�����ޡ��ȶ���ij��ѧС���Ʊ�����ͭ���岢�ⶨ��Ʒ��ͭ�ĺ�����ʵ�����¡�
��.����ͭ������Ʊ���
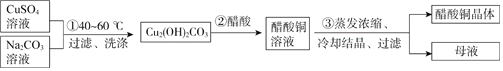
(1)�����ӷ���ʽ��ʾ���̢ٲ�����OH-����Դ��___________��
(2)���̢ڶ�Ӧ�Ļ�ѧ����ʽ�ǣ�___________��
��.�ⶨ��Ʒ��ͭ�ĺ���
i.ȡag����ͭ��Ʒ�����ĥ�����ӵ���ƿ�У���ϡ�����ܽ⣬�������KI��Һ����Cul��������Һ���ػ�ɫ��
ii.��b mol��L -1Na2S2O3����Һ�ζ�i�е���Һ��dz��ɫʱ�����뼸�ε�����Һ����Һ������������Na2S2O3����Һ�ζ�����ɫ������ʧ��(��֪��2![]() +I2��
+I2��![]() +2I-)
+2I-)
iii.��������Һ�м���KSCN��Һ�����ҡ������Һ��ɫ���
iv.������Na2S2O3����Һ�ζ�����Һ���յ㣬���ı���ҺvmL��
��֪����Na2S2O3��Һ��Na2S4O6��Һ��ɫ��Ϊ��ɫ��
��Cul������I2����������I2������۷� CuSCN����ɫ��Ӧ��������ˮ�Ҳ�����I2
(3)i�з�����Ӧ�����ӷ���ʽ��_________��
(4)����ͭ��Ʒ��ͭԪ�ص�����������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֧�Թ��зֱ����������ͬ����ɫ��Һ�������²�����������ȷ����(����)
ѡ�� | ���������� | ���� |
A | ����AgNO3��Һ�����ɰ�ɫ�������ټ�ϡ����������ܽ� | ԭ��Һ����Cl-���� |
B | ͨ��Cl2����Һ��Ϊ���ɫ���������������Һ����Һ���� | ԭ��Һ����I-���� |
C | ����Ba(NO3)2��Һ�����ɰ�ɫ��������ϡ�����������ܽ�ʱ | ԭ��Һ���� |
D | ����ϡ���ᣬ���ɵ�������ʹ����ʯ��ˮ����� | ԭ��Һ���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com