
A、
| ||||||||
| B、1 mol CH4与1 mol NH4+所含质子数相等 | ||||||||
| C、等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等 | ||||||||
| D、二氧化硫溶于水所得的溶液可导电,说明二氧化硫是电解质 |
20 10 |
22 10 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
| B、氧族元素氢化物稳定性按H2O、H2S、H2Se、H2Te的顺序依次减小 |
| C、氢化物的沸点按NH3、BiH3、SbH3、AsH3、PH3的顺序依次递减 |
| D、最高价氧化物对应水化物碱性按NaOH、KOH、RbOH、CsOH的顺序依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液和过量氢氧化钙溶液混合:Ca2++2HCO3-+OH-═CaCO3↓+CO32-+H2O |
| B、CuCl2溶液与Na2S溶液2:1反应,Cu2++S2-═CuS↓ |
| C、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
| D、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Ca(OH)2 | Al(OH)3 | Fe(OH)3 |
| 完全沉淀时pH | ≥13 | ≥5.2 | ≥3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
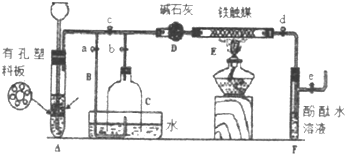
查看答案和解析>>
科目:高中化学 来源: 题型:
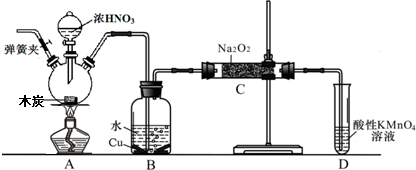
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中:Na+、MnO4-、SO42-、K+ |
| B、使蓝色石蕊试纸变红的溶液中:K+、S2-、NO3-、OH- |
| C、加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl- |
| D、含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com