
【题目】在一定温度下的某恒容密闭容器中,建立下列化学平衡:C(s)+H2O(g) ![]() CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
A.体系压强不再发生变化B.v正(CO)=v逆(H2O)
C.生成 n molCO 的同时生成 n mol H2D.1 mol HH 键断裂的同时形成 2 mol HO 键
科目:高中化学 来源: 题型:
【题目】2018年8月31日,华为公司发布AI芯片麒麟980,这标志着我国高科技企业的芯片制造技术迈入国际领先水平。组成芯片的核心物质是高纯度硅。下图是以石英砂为原料同时制备硅和金属锂。

已知:LiCl的熔点是605℃、沸点是1350℃;NH4Cl在100℃开始挥发,337.8℃分解完全。常温下,Ksp[Fe(OH)3]=2.64×10-39,Ksp[Al(OH)3]=1×10-33。
(1)粗硅中常含有副产物SiC,请写出①中生成SiC的反应方程式_______。写出②中的反应方程式_______。
(2)请写出操作名称:a_____;b_______。
(3)请写出试剂X是______。
(4)本生产工艺要求,要控制LiCl和NH4Cl溶液中的杂质离子浓度在1.0×10-6mol·L-1以下,应控制溶液的pH为_____,此时溶液中Fe3+的浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种易溶于水的化合物只由表中的八种离子组成,且四种化合物中阴、阳离子各不相同。
阴离子 | Cl-、SiO32-、OH-、NO3- |
阳离子 | H+、Ag+、Na+、K+ |
已知:A溶液呈强酸性,且A溶液与B、C溶液混合均产生白色沉淀,B的焰色反应呈黄色。
回答下列问题:
(1)写出A、B、C、D的化学式:A______,B_____,C____,D____。
(2)写出A溶液与B溶液反应的离子方程式: __________。
(3)请选出适合存放A、C、D溶液的试剂瓶的序号:

溶液 | A | C | D |
试剂瓶序号 | ___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关2个电化学装置的叙述正确的是

A. 装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B. 在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C. 装置②中采用石墨电极,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
D. 若装置②用于铁棒镀铜,则N极为铁棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可从铅蓄电池中回收铅,实现铅的再生。在工艺中得到含Na2PbCl4的电解液,电解Na2PbCl4溶液后生成Pb,如图所示。下列说法不正确的是

A. 阳极区会有气泡冒出,产生O2
B. 一段时间后,阳极附近pH明显增大
C. 阴极的电极反应方程式为PbCl42+ 2e ![]() Pb + 4Cl-
Pb + 4Cl-
D. Na2PbCl4浓度下降后可在阴极区加入PbO,实现电解液的继续使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 邻羟基苯甲醛的沸点比对羟基苯甲醛的高
B. 基态碳原子的最外层电子排布图:![]()
C. 原子核外价电子排布式分别为3s1和3s23p5两种元素,不能形成AB2型化合物
D. 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”——钛酸(BaTiO3)的工艺流程如下:
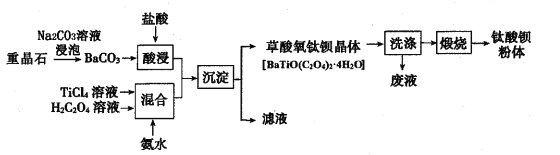
回答下列问题:
(l)为提高BaCO3的酸浸速率,可采取的措施为__(写出一条即可);常温下,TiCl4为液体且易水解,配制一定浓度的TiCl4溶液的方法是 ____。
(2)用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ___(填写计算结果);若不考虑CO32-的水解,要使2. 33g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1.0mol·L-1Na2CO3溶液 ___mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
(3)流程中“混合”溶液的钛元素在不同pH时主要以TiO(OH)+、TiOC2O4、TiO(C2O4)22-三种形式存在(变化曲线如右图所示)。实际制备工艺中,先用氨水调节混合溶液的pH于2.8左右,再进行“沉淀”,其反应的离子方程式为____;图中曲线c对应钛的形式为____(填粒子符号)。
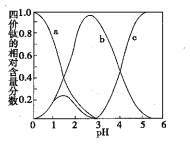
(4)流程中“滤液”的主要成分为____;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和气态产物,试写出反应的化学方程式:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com