
【题目】Ⅰ.如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
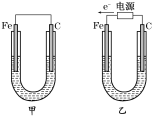
①有红色物质析出的分别是甲、乙装置中的________。
A.甲中的Fe棒,乙中的Fe棒 B.甲中的C棒,乙中的Fe棒
C. 甲中的C 棒,乙中的Fe棒 D.甲中的C棒,乙中的C棒
②乙装置中阳极的电极反应式是:____________________________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:_________________________________________。
②将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:___________。
Ⅱ.如图为绿色电源“甲烷燃料电池”的工作原理示意图。
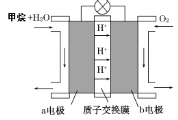
负极的电极反应为______________________
【答案】 B 4OH--4e-=2H2O+O2↑ 2Cl-+2H2O ![]() Cl2↑+H2↑+2OH- 在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝 CH4-8e-+2H2O==CO2+8H+
Cl2↑+H2↑+2OH- 在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝 CH4-8e-+2H2O==CO2+8H+
【解析】本题考查原电池、电解池和燃料电池的相关知识。解答时抓住原电池和电解池的工作原理进行判断。(1)活泼金属做负极,电子是由负极经导线流向正极。(2)在电解池中是阳极与正极相连,阴极与负极相连。根据放电顺序进行判断。(3)燃料电池是燃料做负极,氧气做正极。
Ⅰ(1)①甲为原电池,Fe为负极,碳棒做正极,发生的电极反应为Cu2++2 e-= Cu,所以碳电极上生成红色物质Cu,乙为电解池,根据电子流向知Fe为阴,电极反应为Cu2++2 e-= Cu,所以答案为:B。
②乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,碳棒做阳极,氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①乙为电解池,电解NaCl溶液生成NaOH、氢气、氯气,所以离子反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故答案为2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
②碳电极为阳极,阳极上生成氯气,氯气和碘离子发生置换反应生成碘,碘遇淀粉试液变蓝色,答案:在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝。
Ⅱ为甲烷燃料电池,燃料做负极,氧气做正极。根据甲烷燃料燃烧知在酸性介质中负极的电极反应方程式为:CH4-8e-+2H2O=CO2+8H+。答案:CH4-8e-+2H2O=CO2+8H+。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述正确的是( )
A.金属钠是银白色金属,密度大,熔点高
B.金属钠硬度小,很容易用小刀切割成小块
C.在空气中加热时,金属钠剧烈燃烧,产生黄色火焰和白色固体
D.将金属钠投入硫酸铜溶液中,钠迅速反应,产生红色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用铁片与稀硫酸反应制氢气.下列措施中,不能使氢气生成速率加大的是( )
A.加热
B.不用稀硫酸,改用98%浓硫酸
C.将铁片改为镁条
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应:M(气)+N(气)R(气)+2L(?)此反应符合下面图象,下列叙述正确的是( )
A.正反应放热,L是气体
B.正反应吸热,L是固体
C.正反应吸热,L是气体
D.正反应放热,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= .
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.
实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL 18molL﹣1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是__________
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得Ca(ClO)2产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。
(4)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,该反应中每生成1molCl2,转移电子的物质的量为__________mol。
(5)有效氯是漂粉精中有效Ca(ClO)2的含量大小的标志。已知:有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)![]() 100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为__________(保留一位小数)
100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为__________(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:

请回答下列问题:
(1)滤渣1的化学式为_______,
(2)沉淀X的化学式为______________。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________。
(4)“一系列操作”包括过滤、洗涤、干燥。洗涤沉淀的操作为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:
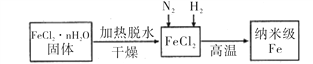
(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com