
【题目】下列关于金属钠的叙述正确的是( )
A.金属钠是银白色金属,密度大,熔点高
B.金属钠硬度小,很容易用小刀切割成小块
C.在空气中加热时,金属钠剧烈燃烧,产生黄色火焰和白色固体
D.将金属钠投入硫酸铜溶液中,钠迅速反应,产生红色固体
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 等质量的甲烷和乙烯完全燃烧,甲烷消耗的O2多
B. C5H11Cl有6种同分异构体
C. 聚乙烯与乙烯性质相似,可使溴水褪色
D. 正丁烷和异丁烷互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F(C11H12O2)属于芳香酯类物质,可由下列路线合成:
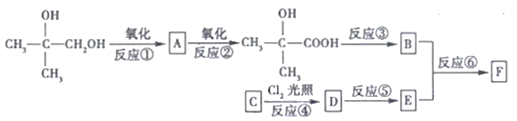
请回答下列问题:
(1)A中官能团的名称是__________,上述③④⑤⑥中属于取代反应的是_______________。
(2)C物质的名称是_______,反应③的条件是________________________。
(3)B在一定条件下可以形成高分子化合物,写出此过程的化学方程式:_________________。
(4)反应⑥的化学方程式为___________________________________。
(5)A、B、E三种有机物,可用下列的某一种试剂鉴别,该试剂是_______________________。
a.新制的Cu(OH)2悬浊液 b.溴水
c.酸性KMnO4溶液 d.溴的CC14溶液
(6)G是E的同系物且相对分子质量比E大28。G有多种同分异构体,其中符合下列条件的同分异构体有____种,其中核磁共振氢谱有5组峰,且面积比为6:1:2:2:1的结构简式为_____________________。
①能与Na2CO3溶液反应 ②分子中含有两个一CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质的溶解性“相似相溶”的一般规律,说明溴、碘单质在四氯化碳中比在水中溶解度大,下列说法正确的是( )
A. 溴、碘单质和四氯化碳中都含有卤素
B. 溴、碘是单质,四氯化碳是化合物
C. Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水是极性分子
D. 以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的酸性溶液中,能共存的离子组是
A.NH4+、Cl-、Fe3+、K+B.Na+、CO32-、Ca2+、Cl-
C.MnO4-、Fe2+、Na+、SO42-D.K+、SO42-、HCO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、H2S等是极性分子,CO2,BF3,CCl4等是含极性键的非极性分子。根据上述实例可推出ABn型分子是非极性分子的经验规律是( )
A. 分子中不能含有氢原子
B. 在ABn分子中A的相对原子质量应小于B的相对原子质量
C. 在ABn分子中A原子没有孤电子对
D. 分子中每个共价键的键长应相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与胶体性质有关的是( )
A.利用醋酸除去锅炉中的水垢
B.家用滤芯式净水器中利用活性炭净水
C.清晨在树林中可以看到一缕缕光束
D.向氯化铁溶液中滴加氢氧化钠溶液产生红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g)△H<0 完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率 mol(Lmin)﹣1;该反应的平衡常数表达式K= .
(2)上述反应达到平衡后,下列说法正确的是 .
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量,平衡向左移动
d.其他条件不变,增大HCl物质的量,平衡向左移动
(3)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L.计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
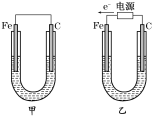
①有红色物质析出的分别是甲、乙装置中的________。
A.甲中的Fe棒,乙中的Fe棒 B.甲中的C棒,乙中的Fe棒
C. 甲中的C 棒,乙中的Fe棒 D.甲中的C棒,乙中的C棒
②乙装置中阳极的电极反应式是:____________________________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:_________________________________________。
②将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:___________。
Ⅱ.如图为绿色电源“甲烷燃料电池”的工作原理示意图。
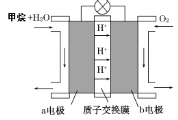
负极的电极反应为______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com