
【题目】NH3、H2S等是极性分子,CO2,BF3,CCl4等是含极性键的非极性分子。根据上述实例可推出ABn型分子是非极性分子的经验规律是( )
A. 分子中不能含有氢原子
B. 在ABn分子中A的相对原子质量应小于B的相对原子质量
C. 在ABn分子中A原子没有孤电子对
D. 分子中每个共价键的键长应相等
科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是( )
A.CH4+Cl2 ![]() CH3Cl+HCl
CH3Cl+HCl
B.CH2═CH2+Br2→CH2BrCH2Br
C.2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.![]() +HNO3
+HNO3 ![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.78g苯中含有的碳碳双键数目为3NA
D.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来连续出现的铊中毒事件,给各科研单位及学校危险药品的管理敲响了警钟。铊的相关信息卡片如图所示:

(1)铊的原子序数为81,铊在元素周期表中位于第________周期第________族。
(2)若设铊的质量数为A,则铊原子中中子数和质子数之差为____________。
(3)下列推断正确的是________。
A.单质的还原性:Tl>Al B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3 D.氧化性:Tl3+>Al3+
(4)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:
Tl3++2Ag===Tl++2Ag+。下列推断正确的是________。
A.Tl+最外层有1个电子 B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱 D.Tl+的还原性比Ag强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的叙述正确的是( )
A.金属钠是银白色金属,密度大,熔点高
B.金属钠硬度小,很容易用小刀切割成小块
C.在空气中加热时,金属钠剧烈燃烧,产生黄色火焰和白色固体
D.将金属钠投入硫酸铜溶液中,钠迅速反应,产生红色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如下图所示:
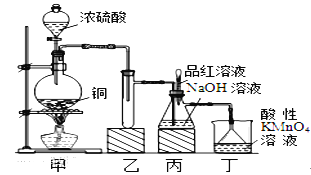
(1)装置甲中发生反应的化学方程式是________________,装置乙的作用是___________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为___________________。
(3)SO2气体有漂白性、还原性和氧化性。将SO2通入溴水中,SO2表现的是__________性,化学反应方程式为_________________________________。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为_____________,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1 mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
实验操作 | 预期现象与结论 |
步骤1:取少量待测液放入试管中,滴加过量1 mol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | (空) |
步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加__________________。 | 若品红褪色(或有气泡),则说明含有Na2SO3。 |
步骤3:用试管取少量A,向其中加入过量___________。 | 若生成白色沉淀,则说明有NaHSO3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g)△H=﹣Q kJmol﹣1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )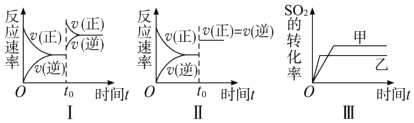
A.图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
C.图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有xMm﹣和yNn+两种简单离子,它们的电子层结构相同.则表示M元素质子数的正确表达式是( )
A.x=y﹣n﹣m
B.x=y+n+m
C.x=y+n﹣m
D.x=y﹣n+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是__________
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得Ca(ClO)2产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。
(4)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,该反应中每生成1molCl2,转移电子的物质的量为__________mol。
(5)有效氯是漂粉精中有效Ca(ClO)2的含量大小的标志。已知:有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)![]() 100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为__________(保留一位小数)
100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为__________(保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com