
【题目】如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等。下列说法中正确的是( )
![]()
A. Y元素的最高价氧化物对应的水化物的化学式为H3YO4
B. Y的最简单气态氢化物的水溶液显弱碱性
C. 原子半径由小到大的顺序为X<Z<Y<W
D. X、Z两种元素的氧化物中所含化学键的类型相同
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第________族。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,利用电解所得气体制36.5%的浓盐酸1000 t,最少需要消耗食盐________t。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:
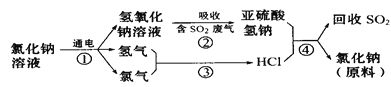
写出②④的化学反应方程式______________________________、 _________________。
(5)上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有________。
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图: 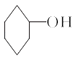
![]()
![]() +H2O,
+H2O, 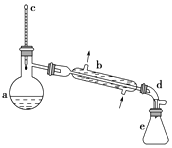
可能用到的有关数据如表:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4 , b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯12g.
回答下列问题:
(1)装置b的名称是 .
(2)本实验中最容易产生的副产物的结构简式为 , 生成该物质的反应类型是
(3)分液漏斗在使用前须清洗干净并 , 在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口倒出”).
(4)在环己烯粗产物蒸馏过程中,不可能用到的仪器有(填正确答案标号).
A.蒸馏烧瓶
B.温度计
C.分液漏斗
D.锥形瓶
E.蒸发皿
(5)本实验所得到的环己烯产率是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表格中各项分类都正确的一组是( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 冰水混合物 | CuSO45H2O | 液态KNO3 | 蔗糖 |
B | CaO | 海水 | 铜 | 酒精 |
C | 液氯 | 铝合金 | AgCl | CO2 |
D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW , 该温度下,将浓度为a mol/L的一元酸HA与b mol/L一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.混合溶液的pH=7
B.混合溶液中,c(H+)= ![]() mol/L
mol/L
C.a=b
D.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g)Fe(s)+CO2(g) 已知该反应在不同温度下的平衡常数如右表所示:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= , △H(填“>”“<”或“=”)0.
(2)在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=、CO的平衡转化率= .
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量
B.加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
(4)1000℃时,某时刻CO2和CO的物质的量浓度分别为0.2molL﹣1和0.1molL﹣1 , 则此时反应是否达到平衡(填“是”或“否”),V(正)V(逆)(填“>”“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com