
����Ŀ����¯���������з�������Ҫ��ӦΪFe2O3��s��+CO��g��Fe��s��+CO2��g�� ��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����ұ���ʾ��
�¶�/�� | 1 000 | 1 150 | 1 300 |
ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �� ��H���������������=����0��
��2����һ���ݻ�Ϊ10L���ܱ������У�1 000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⣮���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ����v��CO2��=��CO��ƽ��ת����= ��
��3������ߣ�2����CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
A.����Fe����
B.��Fe2O3����
C.�Ƴ�����CO2
D.��߷�Ӧ�¶�
E.��С�������ݻ�
F.������ʵĴ���
��4��1000��ʱ��ijʱ��CO2��CO�����ʵ���Ũ�ȷֱ�Ϊ0.2molL��1��0.1molL��1 �� ���ʱ��Ӧ�Ƿ�ﵽƽ������ǡ�����V������V���棩���������������=����
���𰸡�
��1��![]() ����
����
��2��0.006 mol?L��1?min��1 ��60%
��3��C
��4����
���������⣺��1����¯���������з�������Ҫ��ӦΪFe2O3��s��+CO��g��Fe��s��+CO2��g������ѧƽ�ⳣ��Ϊ������Ũ��ϵ�����ݵij˻��뷴Ӧ��Ũ��ϵ�����ݳ˻��ı�ֵ���÷�Ӧ��ƽ�ⳣ������ʽK= ![]() ���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС���������¶�ƽ�����淴Ӧ�ƶ�������ӦΪ���ȷ�Ӧ������H��0�� ���Դ��ǣ�
���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС���������¶�ƽ�����淴Ӧ�ƶ�������ӦΪ���ȷ�Ӧ������H��0�� ���Դ��ǣ� ![]() ��������2����ƽ��ʱCO�����ʵ����仯Ϊnmol����
��������2����ƽ��ʱCO�����ʵ����仯Ϊnmol����
Fe2O3��s��+ | CO��g�� | Fe��s��+ | CO2��g�� | |
��ʼ��mol/L�� | 1 | 1 | 1 | 1 |
ת����mol/L�� | n | n | n | n |
ƽ�⣨mol/L�� | 1-n | 1-n | n+1 | n+1 |
����K= ![]() =
= ![]() =4�����n=0.6��
=4�����n=0.6��
����v��CO2��= ![]() =0.006 molL��1min��1 ��
=0.006 molL��1min��1 ��
CO��ƽ��ת����Ϊ ![]() ��100%=60%��
��100%=60%��
���Դ��ǣ�0.006 molL��1min��1��60%����3��A�����ǹ��壬����Fe��������Ӱ��ƽ���ƶ���CO��ƽ��ת���ʲ��䣬��A����
B���������ǹ��壬����Fe2O3��������Ӱ��ƽ���ƶ���CO��ƽ��ת���ʲ��䣬��B����
C���Ƴ�����CO2 �� ƽ��������Ӧ�ƶ���CO��ƽ��ת��������C��ȷ��
D���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ����߷�Ӧ�¶ȣ�ƽ�����淴Ӧ�ƶ���CO��ƽ��ת���ʽ��ͣ���D����
E����Ӧǰ����������ʵ������䣬��С�������ݻ�������ѹǿƽ�ⲻ�ƶ���CO��ƽ��ת���ʲ��䣬��E����
F��������ʵĴ�����ƽ�ⲻ�ƶ�����F����
���Դ��ǣ�C����4��1000��ʱ��ijʱ��CO2��CO�����ʵ���Ũ�ȷֱ�Ϊ0.2molL��1��0.1molL��1 �� ���ʱQc= ![]() =
= ![]() =2��4.0��˵����Ӧ������У�δ�ﵽƽ�⣬V��������V���棩��
=2��4.0��˵����Ӧ������У�δ�ﵽƽ�⣬V��������V���棩��
���Դ��ǣ�����
�����㾫����������Ҫ�����˻�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ�������֪ʶ�㣬��Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%������ȷ�����⣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪԪ�����ڱ���һ����,����X��Y��Z��WΪ���ֶ�����Ԫ�ء�ZԪ��ԭ�Ӻ���K����M���ϵĵ�������ȡ�����˵������ȷ����(����)
![]()
A. YԪ�ص�����������Ӧ��ˮ����Ļ�ѧʽΪH3YO4
B. Y�������̬�⻯���ˮ��Һ��������
C. ԭ�Ӱ뾶��С�����˳��ΪX<Z<Y<W
D. X��Z����Ԫ�ص���������������ѧ����������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ���ѧ���У�Ϊ��ѧ���������ش�����
A. ����ܣ�����ϡ����ȡ���ۣ� B. �����ϣ������µĿ�ű��ҩ��
C. Ԭ¡ƽ�������ӽ�ˮ���� D. Ǯѧɭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2L��3���ܱ������з�����Ӧ3A��g��+B��g��xC��g��������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 3mol A��2mol B | 6mol A��4mol B | 2mol C |
����ƽ���ʱ�䣨min�� | 5 | 8 | |
A��Ũ�ȣ�mol/L�� | c1 | c2 | |
C��������� | w1 | w3 | |
��������ܶȣ�g/L�� | ��1 | ��2 |
����˵����ȷ���ǣ� ��
A.��x��4����2c1��c2
B.��w3=w1 �� �ɶ϶�x=4
C.����x��ֵ�Ƕ��٣�����2��1=��2
D.�������з�Ӧ�ӿ�ʼ����ƽ��ƽ������Ϊv��A��=0.3 molL��1min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ����������ǣ�������
A.����B.����
C.���Ӻ�����D.���ӡ����Ӻ͵���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һһ�������Ե��ǣ� ��
A.pH��7����Һ
B.c��H+����c��OH���� ����Һ
C.pH��7����Һ
D.c��H+����c��OH���� ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϸ�������Ԫ���У������Ԫ�ء���������Ԫ�طֱ���
A.N��C
B.C��O
C.C��H
D.��ΪC
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���縡ѡ���۷��ǹ�ҵ�ϲ��õ�һ����ˮ����������������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3������Fe��OH��3�������ԣ�������������������������о���ˮ�����ã�ģ���װ����ͼ��ʾ������˵��������ǣ������� 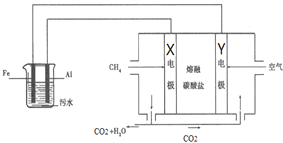
A.X�缫�Ǹ������缫��ӦʽΪ��CH4-8e-+4CO32-�T5CO2+2H2O
B.����������ʧȥ��������Fe2+
C.����ʱ�������е�̼�������Y�缫
D.��ˮ�д��ڷ�Ӧ��4Fe2++10H2O+O2�T4Fe��OH��3��+8H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC4H10O���ܱ���������ȩ����л��������У� ��
A.2��
B.3��
C.4��
D.5��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com