
| A、Na |
| B、Na2O2 |
| C、Na2CO3 |
| D、Ca(HCO3)2 |


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、将水加热,KW增大,pH不变 |
| C、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D、向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编 号 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | Ba(OH)2 | BaSO4 |
| 弱电解质 | CH3COOH | CaCO3 | H2S | NH3?H2O |
| 非电解质 | SO2 | CO2 | Cl2 | C2H5OH溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | H+ | AsO33- | Sb3+ | Bi3+ | Fe2+ |
| c(mol?L-1) | 1.0 | 3.6×10-3 | 2.4×10-4 | 1.0×10-4 | 2.0×10-3 |
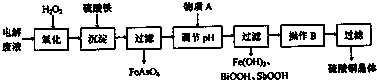
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
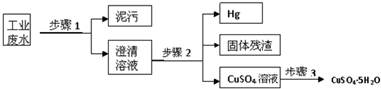
查看答案和解析>>
科目:高中化学 来源: 题型:
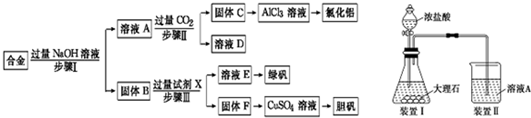
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.粉末中一定有Na20、Na202、NaHC03 |
| B、.粉末中一定不含有Na2C03和NaCl |
| C、粉末中一定不含有Na20和NaCl |
| D、.无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com