
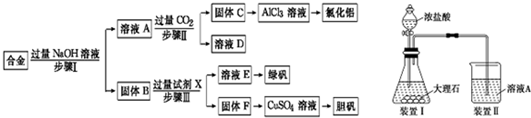


科目:高中化学 来源: 题型:
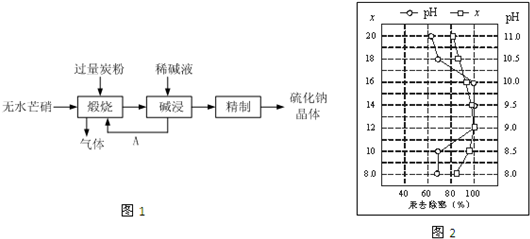
查看答案和解析>>
科目:高中化学 来源: 题型:
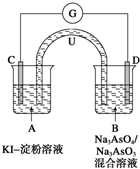
查看答案和解析>>
科目:高中化学 来源: 题型:
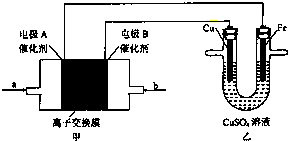
| A、工作是,Cu电极的电极反应为Cu2++2e-=Cu |
| B、工作一段时间后,Cu电极的质量将减小,Fe电极的质量将增加 |
| C、若甲池中a是CH4,b是O2,电解质溶液是KOH,则甲池内溶液的pH将升高 |
| D、若甲池电解质溶液为稀H2SO4,则a为O2,电极A反应为O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
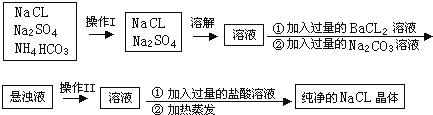
查看答案和解析>>
科目:高中化学 来源: 题型:
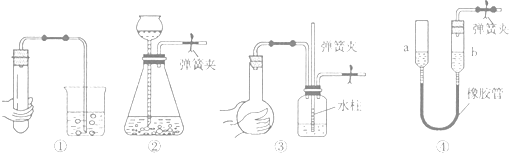
| A、对装置①,双手移去后,导管中水面高于烧杯内水面 |
| B、对装置②,长颈漏斗内液面高度保持不变 |
| C、对装置③,长导管内形成一段水柱 |
| D、对装置④,上下移动a管后,a、b两端液面仍相平 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大 | B、减小 |
| C、不变 | D、无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com