
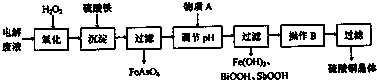
| 离子 | H+ | AsO33- | Sb3+ | Bi3+ | Fe2+ |
| c(mol?L-1) | 1.0 | 3.6×10-3 | 2.4×10-4 | 1.0×10-4 | 2.0×10-3 |
| 2.0×10 -3 |
| 1.2 |
| 3.6×10 -3 |
| 1.2 |
| 2.0×10 -3 |
| 1.2 |
| 2.0×10 -3 |
| 1.2 |
| 3.6×10 -3 |
| 1.2 |
| 2.0×10 -3 |
| 1.2 |
| 2.0×10 -3 |
| 1.2 |


科目:高中化学 来源: 题型:
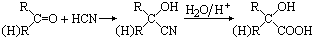 ,
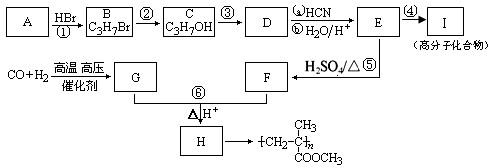
,
查看答案和解析>>
科目:高中化学 来源: 题型:
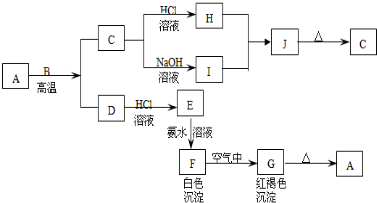
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③ | B、④ | C、③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
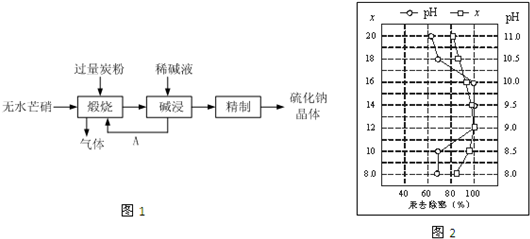
查看答案和解析>>
科目:高中化学 来源: 题型:
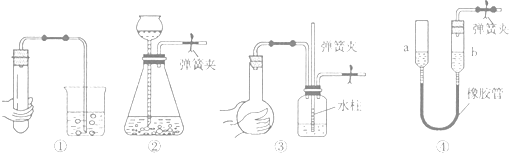
| A、对装置①,双手移去后,导管中水面高于烧杯内水面 |
| B、对装置②,长颈漏斗内液面高度保持不变 |
| C、对装置③,长导管内形成一段水柱 |
| D、对装置④,上下移动a管后,a、b两端液面仍相平 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com