
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.2 L 0.5 mol·L-1H2S溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol SO2与1 mol O2充分反应,产物的分子数为2NA
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
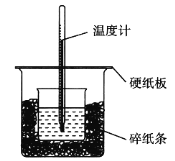
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________________。
(2)烧杯间填满碎纸条的作用是______________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填”偏大”“偏小”或”无影响”)。
(4)实验中改用60 mL 0.50 mol·L1盐酸跟50 mL 0.55 mol·L1 NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填”相等”或”不相等”),所求中和热__________(填”相等”或”不相等”),简述理由:_________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填”偏大”“偏小”或”无影响”,下同);用50 mL 0.50 mol·L1 NaOH溶液进行上述实验,测得的中和热的数值会__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将0.3 mol CO2 和0.2 mol H2通入2 L密闭容器中,进行反应:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g)。下列关于该反应建立平衡的说法正确的( )
CO2(g)+ H2(g)。下列关于该反应建立平衡的说法正确的( )
A.反应刚开始时,生成物浓度最大,正反应速率最小
B.随着反应的进行,反应物浓度逐渐减小,正反应速率逐渐增大
C.达到平衡状态时反应体系中CO2的浓度为0 mol˙L-1
D.该反应建立平衡过程中v―t(时间)图像如图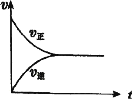
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—24.8kJ·mol-1
②Fe2O3(s)+![]() CO(g)=
CO(g)=![]() Fe3O4(s)+
Fe3O4(s)+![]() CO2(g) △H=—15.73kJ·mol-1
CO2(g) △H=—15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4kJ·mol-1
则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的△H约为( )
A.-218kJ·mol-1B.-109kJ·mol-1C.+218kJ·mol-1D.+109kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是
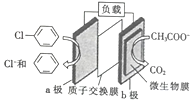
A. b极为正极,发生还原反应
B. 一段时间后b极区电解液的pH减小
C. H+由a极穿过质子交换膜到达b极
D. a极的电极反应式为![]() -e-=Cl-+
-e-=Cl-+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
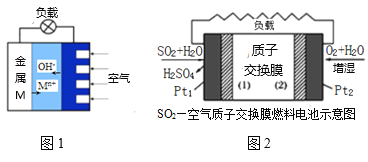
【题目】研究电化学原理与应用有非常量要的意义。
(1)锌锰电池(俗称干电池)是一种一次电池,生活中应用广泛。若锌锰电池工作环境为酸性,则此时负极上的电极反应式为:___。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
①放电时正极反应为(离子方程式):___。
②铅蓄电池放电时,当消耗了10.35gPb时,转移的电子的物质的量为___。
(3)如图1是金属(M)—空气电池的工作原理,我国首创的海洋电池以铅板为负极,铂网为正极,海水为电解质溶液,则该电池反应方程式为:___。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图2所示,则Pt2上的电极反应式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式的△H前者小于后者的是
①C(s)+O2(g)=CO2(g) H1 C(s)+![]() O2(g)=CO(g) H2
O2(g)=CO(g) H2
②S(s)+O2(g)=SO2(g) H3 S(g)+ O2(g)=SO2(g) H4
③H2(g)+![]() O2(g)=H2O(l) H5 H2(g)+
O2(g)=H2O(l) H5 H2(g)+![]() O2(g)=H2O(g) H6
O2(g)=H2O(g) H6
A.①③B.①②C.②③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
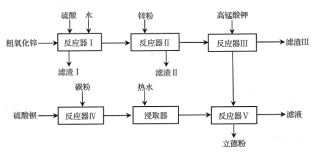
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在工农业生产和日常生活中都有着重要的应用.下列叙述不正确的是![]()
A.长期使用![]() 化肥会使土壤酸化,而过度使用尿素
化肥会使土壤酸化,而过度使用尿素![]() 会使土壤碱化
会使土壤碱化
B.锅炉水垢中含有的![]() ,可先用
,可先用![]() 溶液处理,后用酸除去
溶液处理,后用酸除去
C.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质
D.“酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com