
【题目】丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子为C4H8,A氢化后得到2-甲基丙烷。完成下列填空:
(1)A分子中的官能团的名称为___。
(2)写出将A通入下列两种溶液后出现的现象。
A通入溴水:___,
A通入溴的四氯化碳溶液:___。
(3)写出A氢化后产物2-甲基丙烷的同分异构体的结构简式:___。
(4)A可以聚合,写出A的聚合反应___(以反应方程式表示)。
(5)A发生烷基化反应生成一种烃B,将B完全燃烧后得到CO2和H2O的物质的量之比为8:9,由此可以确定B的化学式为___。通过对B的结构深入研究,发现其一卤代物只有4种,且碳链不对称。写出B的结构简式,并用系统命名法命名:___。
【答案】碳碳双键 溶液褪色,底部出现无色油状物质 溶液褪色 CH3CH2CH2CH3  或
或 ; C8H18
; C8H18 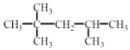 2,2,4-三甲基戊烷
2,2,4-三甲基戊烷
【解析】
A的分子式为C4H8,氢化后得到2-甲基丙烷,可知A的结构简式为CH2=C(CH3)2,A发生加聚反应得到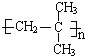 ;
;
A发生烷基化反应生成一种烃B,将B完全燃烧后得到CO2和H2O的物质的量之比为8:9,可推出B的分子式为C8H18,其一卤代物只有4种,等效氢有4种,且碳链不对称,则B为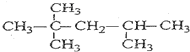 ,据此分析。
,据此分析。
A的分子式为C4H8,氢化后得到2-甲基丙烷,可知A的结构简式为CH2=C(CH3)2,A发生加聚反应得到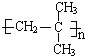 ;
;
(1)A的结构简式为CH2=C(CH3)2,分子中的官能团的名称为碳碳双键;
(2)A通入溴水,则A与溴水发生加成反应得到卤代烃,卤代烃和水互不相溶,故溶液褪色,底部出现无色油状物质;A通入溴的四氯化碳溶液时,则A与溴水发生加成反应得到卤代烃,卤代烃和四氯化碳相溶,故只看到溶液褪色;
(3)A氢化(与H2加成)后得到2-甲基丙烷,2-甲基丙烷的同分异构体正丁烷的结构简式为:CH3CH2CH2CH3;
(4)A发生加聚反应的方式有两种: 、
、 ;
;
(5)A发生烷基化反应生成一种烃B,将B完全燃烧后得到CO2和H2O的物质的量之比为8:9,可推出B的分子式为C8H18,其一卤代物只有4种,等效氢有4种,且碳链不对称,则B为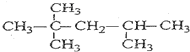 ,名称为2,2,4-三甲基戊烷。
,名称为2,2,4-三甲基戊烷。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O![]() C2O
C2O![]() +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O![]() 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )

A. Ka1=10-1.2
B. pH=2.7时溶液中:![]() =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
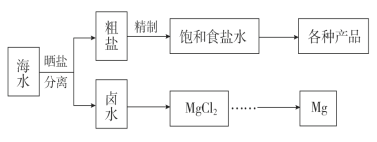
(1)用NaCl作原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是______。
②写出产物氯气制备“84”消毒液的离子方程式:______。
③NaCl也是侯氏制碱法的重要反应物之一,写出侯氏制碱法过程中涉及到的两个主要方程式:__________ , __________。
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O―→NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为________mol。
(3)海水提镁的一段工艺流程如下图:
卤水![]()
![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2![]() Mg
Mg
①采用石墨电极电解熔融的氯化镁,发生反应的化学方程式_________;
②电解时,若有少量水存在,则不能得到镁单质,写出有关反应的化学方程式__________。
(4)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
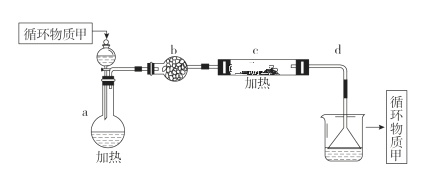
①上图中,装置a由________、________、双孔塞和导管组成。
②循环物质甲的名称是________。
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的纯碱中往往含有少量的NaCl固体,现设计以下两种方案测定样品中纯碱的纯度。完成下列填空:
方案一:测量装置如图所示,称取样品m克装入Y型试管中。
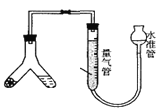
(1)检查装置气密性的方法是__________。
(2)量气管中的液体应为__________(填编号)。
a 饱和Na2CO3溶液 b 饱和NaHCO3溶液 c 饱和NaCl溶液
(3)Y型试管另一端应装入试剂为__________(填编号)。
a 盐酸 b 硫酸 c 硝酸
方案二:装置如图二所示,A中样品质量为m克。
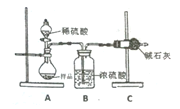
(4)根据图中所用实验装置,可以判断需要测定的实验数据是__________。
(5)仔细分析该装置,由此测的的数据计算出的实验结果有可能偏高也有可能偏低,分析原因并对装置进行相应的改进(已知:装置气密性良好);
(i)偏低的原因是____________,改进方法是__________。
(ii)偏高的原因是_____________,改进方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
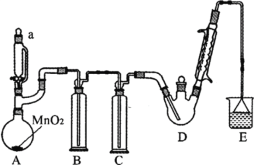
①制备反应原理:C2H5OH + 4Cl2 → CCl3CHO+5HCl
可能发生的副反应:
C2H5OH + HCl → C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(1)仪器a中盛放的试剂是_____ ;装置B的作用是__________ 。
(2)若撤去装置C,可能导致装置D中副产物________ (填化学式)的量增加;装置D可采用_________ 加热的方法以控制反应温度在70℃左右。
(3)装置E中可能发生的无机反应的离子方程式有____________________ 。
(4)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH。你认为此方案是否可行,为什么?_______________
(5)测定产品纯度:称取产品0.30 g配成待测溶液,加入0.1000 mol·L-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 mol·L-1 Na2S2O3溶液滴定至终点。进行平行实验后,测得消耗Na2S2O3溶液20.00 mL。则产品的纯度为_________。
滴定的反应原理:CCl3CHO +OH- → CHCl3 + HCOO-、 HCOO-+ I2 =H+ + 2I- + CO2↑ I2 + 2S2O32- = 2I-+ S4O62-
(6)请设计实验证明三氯乙酸的酸性比乙酸强。 __________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g)N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是
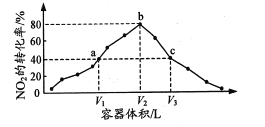
A.T℃时,该反应的化学平衡常数为![]()
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb>6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
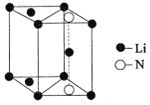
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究某溶液中溶质 R的分解速率的影响因素,分别用三份不同初始浓度 R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法错误的是

A.25℃时,10~30min 内,R 的分解平均速率为 0.030 mol·L-1·min-1
B.对比 30℃和 10℃曲线,在同一时刻,能说明 R的分解速率随温度升高而增大
C.对比 30℃和 25℃曲线,在 0~50min 内,能说明R 的分解平均速率随温度升高而增大
D.对比 30℃和 10℃曲线,在 50min 时,R 的分解率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.![]() 、
、![]() 、
、![]() 互为同系物
互为同系物
B.有机化合物 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.含有5个碳原子的饱和链烃,其一氯取代物有8种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com