
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱。常温下,向200mL0.10mol/L的甲胺溶液中滴加V mL.0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是

A. b点对应加入盐酸的体积V< 20.00mL
B. 甲胺在水中的电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 常温下,甲胺的电离常数为Kb,则pKb=-1gKb=4.3
D. c点可能存在关系: 2c(H+)+ c(CH3NH3+)=c(CH3NH2) +2c(OH- )+ c(Cl-)
【答案】C
【解析】甲胺的物质的量为:![]() 。A、当加入盐酸20.00mL时,HCl物质的量为:
。A、当加入盐酸20.00mL时,HCl物质的量为:![]() ,二者恰好完全反应生成CH3NH3+Cl- ,这是一种强酸弱碱盐,由于CH3NH3+水解溶液呈酸性,因此当盐酸适量减少时,溶液可以呈中性,所以b点pH=7的溶液,加入的HCl体积V<20.00 mL,A正确。B、甲胺的结构类似于氨气NH3,所以甲胺在水中的电离方程式为:CH3NH2+H2O
,二者恰好完全反应生成CH3NH3+Cl- ,这是一种强酸弱碱盐,由于CH3NH3+水解溶液呈酸性,因此当盐酸适量减少时,溶液可以呈中性,所以b点pH=7的溶液,加入的HCl体积V<20.00 mL,A正确。B、甲胺的结构类似于氨气NH3,所以甲胺在水中的电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-,B正确。C、根据B甲胺的电离方程式,
CH3NH3++OH-,B正确。C、根据B甲胺的电离方程式,![]() ,读图可得,当
,读图可得,当![]() 时,pH=10.6,即
时,pH=10.6,即![]() 时,c(H+)=10-10.6,所以Kb= c(OH-)=10-(14-10.6)=10-3.4,pKb=-lgKb=-lg10-3.4=3.4,C错误。D、c点pH<7,溶液呈酸性,所以可能是A提到的消耗20mL盐酸时得到的CH3NH3Cl溶液,根据电荷守恒则有c(H+)+c(CH3NH3+)=c(OH-)+c(Cl-),既2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(Cl-),且溶液中的Cl原子数与N原子数相等,所以c(Cl-)=c(CH3NH3+)+c(CH3NH2),代入上述后一个等式得:2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(CH3NH3+)+c(CH3NH2),化简得到:2c(H+)+c(CH3NH3+)=c(CH3NH2)+2c(OH-)+c(Cl-),D正确。所以错误的答案选择C。
时,c(H+)=10-10.6,所以Kb= c(OH-)=10-(14-10.6)=10-3.4,pKb=-lgKb=-lg10-3.4=3.4,C错误。D、c点pH<7,溶液呈酸性,所以可能是A提到的消耗20mL盐酸时得到的CH3NH3Cl溶液,根据电荷守恒则有c(H+)+c(CH3NH3+)=c(OH-)+c(Cl-),既2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(Cl-),且溶液中的Cl原子数与N原子数相等,所以c(Cl-)=c(CH3NH3+)+c(CH3NH2),代入上述后一个等式得:2c(H+)+2c(CH3NH3+)=2c(OH-)+c(Cl-)+c(CH3NH3+)+c(CH3NH2),化简得到:2c(H+)+c(CH3NH3+)=c(CH3NH2)+2c(OH-)+c(Cl-),D正确。所以错误的答案选择C。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】对合金的性质或应用,下列说法不正确的是( )
A.合金的硬度一般比它的各成分金属的小,多数合金的熔点一般也比它的各成分金属的高
B.合金在工业上具有比纯金属更广泛的用途
C.制饭勺、饭盒、高压锅等的不锈钢是合金
D.青铜是我国使用最早的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】括号内物质为杂质,在实验室中,下列除杂的方法中正确的是
A.溴苯(溴):加入KI溶液,振荡,分液
B.乙烷(乙烯):通入H2在一定条件下反应,使乙烯转化为乙烷
C.乙醇(水):用生石灰吸水后蒸馏
D.乙烯(CO2和SO2):将其通入酸性KMnO4溶液中洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年,美国研究小组开发出一种以糖为能源,可循环使用的环保电池装置。其工作原理如图所示。下列说法错误的是
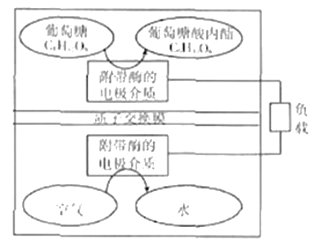
A. 葡萄糖在电池负极发生反应
B. 装置所示原理可以在强碱性条件下进行
C. 装置正极电极反应式为:O2+4e-+4H+=2H2O
D. 装置工作时,每消耗180g葡萄糖,将有2mol质子通过交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或该物质性质的应用均正确的是( )
A. 醋酸溶液与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些
B. 明矾净水与自来水的杀菌清毒原理是一样的
C. MgO和Al2O3在工业上用于制作耐高温材料,可用电解此两种物质冶炼镁、铝金属
D. 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物应用广泛,但氮氧化物也是主要的空气污染物之一,要对其进行处理和再利用。
I.脱硝法:
(1)已知H2的燃烧热△H= -285.8kJ/mol,N2(g) +O2(g)=2NO(g) △H= + 180kJ/mol。一定条件下,H2还原NO生成液态水和一种无毒物质的热化学方程式为_______________________。
II.化合法:
工业上用NO和Cl2化合制备重要的合成用试剂NOCl( 亚硝酰氯)气体。
(2)NOCl中N 元素的化合价为__________,NOCl的电子式为_____________________。
(3)向1L恒容密团容器中通入2molNO(g)和1molCl2(g)发生反应:2NO(g) + Cl2(g)![]() 2NOCl(g) △H,在不同温度下测得c(NOCl)与时间t的关系如图所示。
2NOCl(g) △H,在不同温度下测得c(NOCl)与时间t的关系如图所示。

①该反应的△H_____0(填“>"或“<”或“=”),理由是_____________________。
②温度T1时,Cl2(g)在0~20min的平均反应速率为__________mol/(L·min)。
③温度T2时,该反应的平衡常数K=______(结果保留小数点后2位)。若反应在T2达到平衡后,再向容器中充入2molNO(g)和1molCl2(g),当再达平衡时,c(NOCl)=______(填“>”或“<”或“一”)1mol/L。
III.电化学法:
用下图所示装置可以模拟消除NO2获得铵态氮肥的过程。

(4)该装置阳极电极反应式为____________________________。
(5)电解后,向所得溶液中通入适量NH3可增加铵态氮肥的产量,理由是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】规律方法提炼题组:有关物质的量的计算
(1)在标准状况下,67.2LCO2是__________mol,质量为_______g,含有__________个CO2分子,其中含有__________mol氧原子。
(2)在标准状况下,1.7g氨气所占的体积约为_________L,它与同条件下_____mol H2S含有相同的氢原子数。
(3)某气态氧化物化学式为RO2,在标准状况下,1.28g该氧化物的体积是448mL,则氧化物的摩尔质量为_______,R的相对原子质量为__________。
(4)实验室常用浓硫酸的质量分数为98%,密度为1.80g·mL-1,其物质的量浓度是_______。
(5)标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1L水(密度1 g/cm3)中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度为_______mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(6)学法题:通过以上训练思考,解决这些问题的关键是将其它量均先转化为____再计算。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。反应时释放大量热并快速产生大量气体。已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是____________ 。
又知:H2O(g )=H2O (l) △H=-44 kJ·mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为__________kJ。
(2)已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式是___________________________。
(3)写出分子式为C8H10含苯环的所有同分异构体_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中有两个关于混合物分离的实验,请回答下列有关问题
实验一:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示

(1)写出下列仪器的名称:①___________ ②_____________
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是______________,将仪器补充完整后进行的实验操作的名称是______________;②的进水口是__________ (填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是___________________
实验二:用CCl4从碘水中萃取I2并分液漏斗分离两种溶液.
其实验操作中有如下两步:
①将漏斗上口玻璃塞打开或使塞上的凹槽或小孔准漏斗的小孔.
②静置分层后,旋开活塞,用烧杯接收下层液体
(4)下层流出的是_____________溶液,上层液体从_________________ 得到(填“上口”或“下口”)
(5)萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是(______)
A.不与碘反应
B.碘在其中的溶解度大于在水中的溶解度
C.该萃取剂与水不互溶且密度不同
D.可以选用CCl4、 酒精灯做萃取剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com