
����Ŀ�������£���һԪ�� HA ����Һ�� KOH ��Һ��������(��������仯)��ʵ���������±���
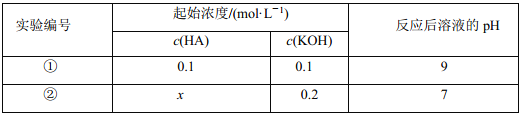
�����жϲ���ȷ����( )
A��ʵ������Ӧ�����Һ�У�c(K+)>c(A��)>c(OH��)>c(H+)
B��ʵ������Ӧ�����Һ�У�c(OH��)��c(K+)��c(A��)��![]()
C��ʵ������Ӧ�����Һ�У�c(A��)+c(HA)>0.1 mol/L
D��ʵ������Ӧ�����Һ�У�c(K+)��c(A��)>c(OH��)��c(H+)
���𰸡� B
��������
��������������£����������Ũ�ȵ�HA��KOH���(��������仯)����Һ�ʼ��ԣ�˵�����������ᡣA����Һ�д��ڵ���غ㣬��c(K+)+c(H+)=c(A-)+c(OH-)��������ǿ�������Σ�����Һ�ʼ��ԣ�c(OH-)��c(H+)��ˮ�ĵ������������c(A-)��c(OH-)����A��ȷ��B����Һ�д��ڵ���غ㣬��c(K+)+c(H+)=c(A-)+c(OH-)��c(OH-)-c(H+)=c(K+)-c(A-)=![]() mol/L-10-9 mol/L����B����C���������ʵ�������ͼ�ǡ�÷�Ӧʱ����Һ�ʼ��ԣ�Ҫʹ���������ͼ��Ϻ���Һ�����ԣ������Ũ��Ӧ���ڼ���������غ��c(A-)+c(HA)��0.1 mol/L����C��ȷ��D����Һ�д��ڵ���غ㣬��c(K+)+c(H+)=c(A-)+c(OH-)����Һ�����ԣ���c(OH-)=c(H+)����c(K+)=c(A-)��������Һ��ˮ�ĵ������������c(A-)��c(OH-)����D��ȷ����ѡB��
mol/L-10-9 mol/L����B����C���������ʵ�������ͼ�ǡ�÷�Ӧʱ����Һ�ʼ��ԣ�Ҫʹ���������ͼ��Ϻ���Һ�����ԣ������Ũ��Ӧ���ڼ���������غ��c(A-)+c(HA)��0.1 mol/L����C��ȷ��D����Һ�д��ڵ���غ㣬��c(K+)+c(H+)=c(A-)+c(OH-)����Һ�����ԣ���c(OH-)=c(H+)����c(K+)=c(A-)��������Һ��ˮ�ĵ������������c(A-)��c(OH-)����D��ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ��ӦSO2(g)��NO2(g) ![]() SO3(g)��NO(g)�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ�����ǣ� ��
SO3(g)��NO(g)�ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ�����ǣ� ��
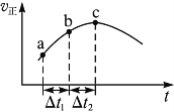
A����Ӧ��c��ﵽƽ��״̬
B����Ӧ��Ũ�ȣ�a��С��b��
C����Ӧ��������������������������
D����t1����t2ʱ��SO2��ת���ʣ�a��b��С��b��c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��19������Ҷ����Ԫ�����������ش��Ŀ�ѧ���ǣ� ��
A.��������
B.�Ž��з�
C.������
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼȿ��������������ֿ�������ζ������(����)
A. �������� B. ʳ��
C. ���ʻ� D. ζ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���У�����NO�ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ� ��
2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ� ��
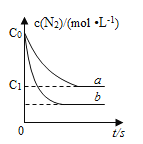
A���¶�T�£��÷�Ӧ��ƽ�ⳣ��K=![]()
B���¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C������b��Ӧ�������ı�����Ǽ����˴���
D��������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ�ӽṹ��Ԫ�����ʵ�˵����ȷ���ǣ� ��
A.�ǽ���Ԫ����ɵĻ�������ֻ�����ۼ�
B.��A�����Ԫ����ͬ�����н�������ǿ��Ԫ��
C.ͬ��Ԫ�ص�ԭ�Ӿ�����ͬ����������������
D.��A��Ԫ�ص������ӻ�ԭ��Խǿ��������������Ӧˮ���������Խǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ���������������������������
��1��Aѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯������200mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£��ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
���������mL������״���� | 100 | 240 | 464 | 576 | 620 |
�ٷ�Ӧ��������ʱ����ǣ�ָ0��1��1��2��2��3��3��4��4��5 ��____min��ԭ����_________________��
����2��3����ʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����________________��������Һ������䣩
��2��Bѧ��Ҳ��ͬ����ʵ�飬�����ڷ�Ӧ̫�죬�ⲻ�������������취���ͷ�Ӧ���ʣ��������ѡ���������м�������__________�Լ�����Ӧ���ʡ�����д���ţ�
A������ˮ B������ C��HNO3��Һ D��CuSO4��Һ
��3��ij�¶�����10L�ܱ������У�3����̬����A��B��C�����ʵ�����ʱ��仯������ͼ��

�ٸ÷�Ӧ�Ļ�ѧ����ʽ��________��
�����ڸ������ﵽ��Ӧ���ȣ�ƽ��״̬��ʱ��Ӧ���ת���ʡ�ת����=��ת�������ʵ���/��ʼ���ʵ�������100%������д��������̣�����������1λС����________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ��Cl�������ʵ����������� ��
A��200mL 2mol/L MgCl2��Һ
B��150mL 5mol/L KClO3��Һ
C����״���£�13.44L��HCl����
D��29.25gNaCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����ʢ��NaOH��Һ���Լ�ƿӦѡ��
A. ϸ�������Լ�ƿ B. ϸ�ڲ������Լ�ƿ
C. ��������Լ�ƿ D. ��ڲ������Լ�ƿ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com