
【题目】全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池。钒电池电能以化学能的方式存储在不同价态钒离子的硫酸电解液中,通过外接泵把电解液压入电池堆体内,在机械动力作用下,使其在不同的储液罐和半电池的闭合回路中循环流动,采用质子交换膜作为电池组的隔膜,电解质溶液流过电极表面并发生电化学反应,进行充电和放电。下图为全钒液流电池放电示意图:
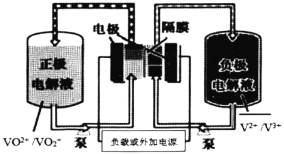
下列说法正确的是( )
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.该电池的储能容量,可以通过增大电解液存储罐的容积并增加电解液的体积来实现
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
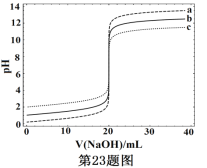
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL0.010 mol·L-1的HA溶液中逐滴加入0.010 mol·L-1的NaOH溶液,溶液中c(OH-)与所加NaOH溶液的体积(V)的关系如图所示。下列说法不正确的是( )
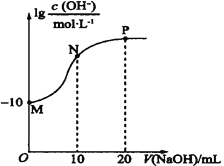
A.常温下,Ka(HA)≈1.0×10-6
B.N点溶液中存在:c(Na+)+c(H+)=c(A-)+c(OH-)
C.P点后的溶液中均存在:c(Na+)>c(A-)>c(OH-)>c(H+)
D.水的电离程度:M<N<P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液。关于镍氢电池,下列说法不正确的是
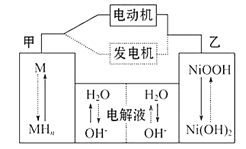
A. 充电时,阴极附近pH降低
B. 电动机工作时溶液中OH-向甲移动
C. 放电时正极反应式为: NiOOH+H2O+e- = Ni(OH)2+OH-
D. 电极总反应式为:M+Ni(OH)2 = MH+NiOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙炔酸甲酯![]() 是一种重要的有机化工原料,沸点为103~105℃。实验室制备少量丙炔酸甲酯的反应为:
是一种重要的有机化工原料,沸点为103~105℃。实验室制备少量丙炔酸甲酯的反应为:![]()
![]()
![]() 。装置如下图:
。装置如下图:
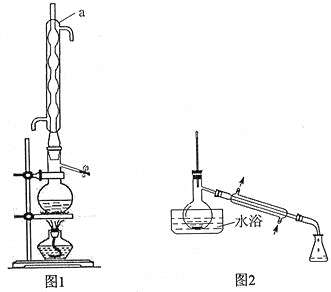
实验步骤如下:
步骤1:在反应瓶中,加入14.0g丙炔酸、50ml甲醇和2ml浓硫酸,少许碎瓷片,加热一段时间(装置见图1)。
步骤2:蒸出过量的甲醇(装置见图2)。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,称得丙炔酸甲酯12.5g。
(1)装置图中仪器a的名称是____________,其作用是__________________。
(2)蒸馏烧瓶中加入碎瓷片的目的是____________。若加热后发现未加碎瓷片,应采取的正确方法是____________________________。
(3)步骤1中,加入过量甲醇的目的除作溶剂外,还有________________。
(4)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是________________;分离出有机相的操作名称为____________。
(5)步骤4中,蒸馏时不能用水浴加热的原因是______________________________。
(6)本实验的产率是________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
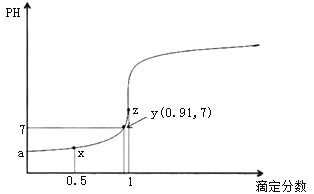
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.恒容密闭容器中的反应3A(g)![]() B(g)+C(g),平衡后再充入少量A气体,A的转化率增大
B(g)+C(g),平衡后再充入少量A气体,A的转化率增大
B.SO2的催化氧化是一个放热的反应,所以升高温度,反应的速率减慢
C.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
D.反应NH3(g)+HCl(g![]() NH4C1(s) ΔH<0,在任何条件下均能自发进行
NH4C1(s) ΔH<0,在任何条件下均能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。

依据上述转化关系,回答下列问题:
(1)丙烯分子中,最多有________个原子在同一个平面上。
(2)聚合物F的结构简式是________________________。
(3)写出B→C的化学方程式:__________________________________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酰氯(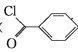 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
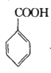 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 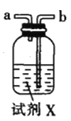 乙.
乙. 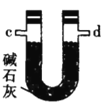 丙.
丙. 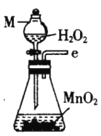 丁.
丁.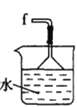 戊.
戊. 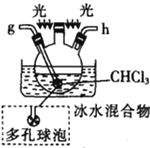
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
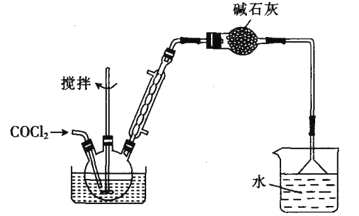
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com