
【题目】常温下,向20 mL0.010 mol·L-1的HA溶液中逐滴加入0.010 mol·L-1的NaOH溶液,溶液中c(OH-)与所加NaOH溶液的体积(V)的关系如图所示。下列说法不正确的是( )
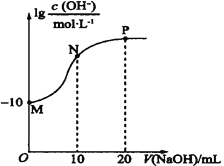
A.常温下,Ka(HA)≈1.0×10-6
B.N点溶液中存在:c(Na+)+c(H+)=c(A-)+c(OH-)
C.P点后的溶液中均存在:c(Na+)>c(A-)>c(OH-)>c(H+)
D.水的电离程度:M<N<P
【答案】C
【解析】
y轴坐标为lgc(OH-),在M点时,溶液中c(OH-)=10-10mol/L,常温时c(H+)=10-4mol/L,则HA为一元弱酸。
A. 常温下,Ka(HA)= ![]() =
=![]() ≈1.0×10-6,A正确;
≈1.0×10-6,A正确;
B. N点溶液中根据溶液呈电中性,存在:c(Na+)+c(H+)=c(A-)+c(OH-),B正确;
C. P点为NaA的溶液,则P点后的溶液为碱过量,当n(NaA)=n(NaOH)时,发生A-+H2OHA+ OH-,则c(OH-)>c(A-),C错误;
D. M、N、P点的溶液分别为HA、HA和NaA的混合液、NaA,酸对水电离有抑制作用,强碱弱酸盐对水的电离有促进作用,则水的电离程度:M<N<P,D正确;
答案为C。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】丙三酸是一种有机酸,用![]() 表示。
表示。![]() 时,向
时,向![]() 的
的![]() 溶液中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数
溶液中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数![]() 随溶液pH的变化曲线如图所示。下列相关说法正确的是
随溶液pH的变化曲线如图所示。下列相关说法正确的是
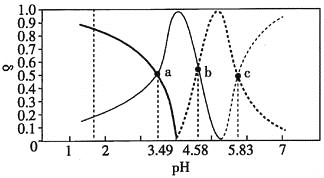
A.a点溶液中:![]()
B.![]() 时,
时,![]() 的第二步电离平衡常数的数量级为
的第二步电离平衡常数的数量级为![]()
C.b点溶液中:![]()
D.当该溶液中![]() 时,溶液中水电离出的
时,溶液中水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物X由3种元素组成。某学习小组进行了如下实验:
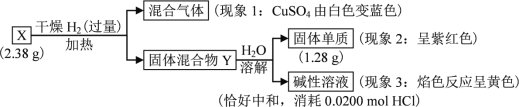
请回答:
(1) 由现象1得出化合物X含有________元素(填元素符号)。
(2) 固体混合物Y的成分________(填化学式)。
(3) X的化学式________。X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到蓝色溶液,该反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的某有机物与足量金属钠反应,可得VAL气体。相同质量的该有机物与适量的Na2CO3浓溶液反应,可得VBL气体。已知在同温、同压下VA和VB不相同,则该有机物可能是
①CH3CH(OH)COOH ②HOOCCOOH ③CH3CH2COOH ④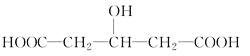
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业从废铅酸蓄电池的渣泥(主要成分为PbSO4、PbO2)回收铅。RSR 工艺的主要流程如下:
![]()
(1)铅酸蓄电池放电时总反应为:
Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l)
正极反应:PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- = PbSO4(s) + 2H2O(l)
负极反应:________。
(2)向渣泥中加入Na2CO3溶液将PbSO4转化为更难溶的PbCO3。
①用化学平衡移动原理解释其原因:________。
②工业上常用NaHCO3溶液代替Na2CO3溶液,将PbSO4转化为PbCO3。PbSO4与NaHCO3溶液或Na2CO3溶液不同物质的量比时,PbSO4的转化率见下表。
Ⅰ | n(PbSO4)∶ n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶ n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 98 | 98 | 98 |
依据上表数据,物质的量比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是________。
③上述反应除生成PbCO3外,还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],二者受热都易分解生成PbO。通过实验确定产物中含有2PbCO3·Pb(OH)2,则该实验操作及现象是________;通过定量实验确定产物中2PbCO3·Pb(OH)2的含量,则需测定的数据是________。
(3)渣泥中加入Na2SO3溶液,利用其性质是________。
(4)H2SiF4溶液溶解PbCO3的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
【答案】C
【解析】①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,说明溶液中含有0.02mol NH4+,同时产生红褐色沉淀为氢氧化铁,说明溶液中含有Fe3+,CO32-与Fe3+会发生双水解而不能大量共存,故溶液中一定不含CO32-;②将沉淀过滤、洗涤、灼烧,得到1.6 g固体为氧化铁,则n[Fe(OH)3]=2n(Fe2O3)=2×![]() =0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)=
=0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)= ![]() =0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
=0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
【题型】单选题
【结束】
8
【题目】根据要求回答下列问题:
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列图像说明该反应进行到t1时刻未达平衡状态的是________(填选项字母)。
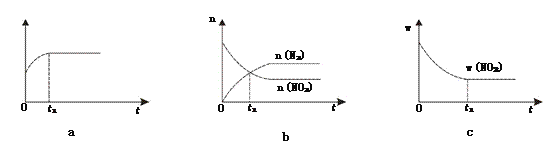
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。
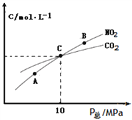
图中A、B、C三点NO2的转化率最高的是_____,该反应的平衡常数Kp=_______(Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
物质 | H2CO | H2S | HNO2 |
电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
②25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
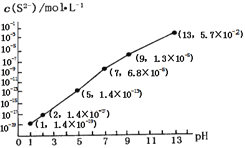
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
则:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸![]() 甲、乙、丙、丁代表不同的一元酸
甲、乙、丙、丁代表不同的一元酸![]() 和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验 编号 | HA的物质的 量浓度 | NaOH的物质的 量浓度 | 混合后溶液的pH |
甲 |
|
| pH |
乙 |
|
| pH |
丙 |
|
|
|
丁 |
|
| pH |
![]() 从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?________________________________________________________________________。
从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?________________________________________________________________________。
![]() 乙组混合溶液中
乙组混合溶液中![]() 和
和![]() 的大小关系是________
的大小关系是________![]() 填标号
填标号![]() 。
。
A.前者大 ![]() 后者大
后者大
C.二者相等 ![]() 无法判断
无法判断
![]() 从丙组实验结果分析,该混合溶液中
从丙组实验结果分析,该混合溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 分析丁组实验数据,写出该混合溶液中下列算式的精确结果
分析丁组实验数据,写出该混合溶液中下列算式的精确结果![]() 列式
列式![]() :
:![]() __________
__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池。钒电池电能以化学能的方式存储在不同价态钒离子的硫酸电解液中,通过外接泵把电解液压入电池堆体内,在机械动力作用下,使其在不同的储液罐和半电池的闭合回路中循环流动,采用质子交换膜作为电池组的隔膜,电解质溶液流过电极表面并发生电化学反应,进行充电和放电。下图为全钒液流电池放电示意图:
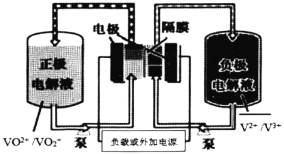
下列说法正确的是( )
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.该电池的储能容量,可以通过增大电解液存储罐的容积并增加电解液的体积来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述或书写正确的是
A.![]()
![]() ,则相同条件下,
,则相同条件下,![]() 气体的能量大于1mol氢气和1mol氟气的能量之和
气体的能量大于1mol氢气和1mol氟气的能量之和
B.![]()
![]() ,则反应物的总键能小于生成物的总键能
,则反应物的总键能小于生成物的总键能
C.含![]() 的稀溶液与稀盐酸完全中和,放出
的稀溶液与稀盐酸完全中和,放出![]() 的热量,则表示该中和反应的热化学方程式为
的热量,则表示该中和反应的热化学方程式为![]()
![]()
D.![]() 、30MPa时,发生反应
、30MPa时,发生反应![]()
![]()
![]() 在此条件下将
在此条件下将![]() 和过量
和过量![]() 充分反应,放出热量
充分反应,放出热量![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com