
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
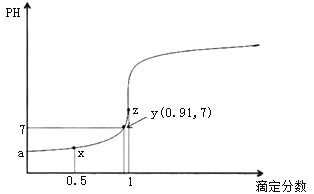
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
【答案】D
【解析】
A.z点滴定分数为1,即恰好完全反应,此时溶液中溶质为NaA,水的电离程度最大, z点之前溶液存在HA抑制水的电离,z点之后溶液中存在NaOH抑制水的电离,所以z点后存在某点,溶液中的水的电离程度和y点的相同,故A正确;
B. HA的电离平衡常数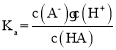 ,设HA的量为1,y点的滴定分数为0.91,pH=7,溶液中电荷守恒得到c(Na+)=c(A-)=0.91,则,c(HA)=1-0.91=0.09,平衡常数K=
,设HA的量为1,y点的滴定分数为0.91,pH=7,溶液中电荷守恒得到c(Na+)=c(A-)=0.91,则,c(HA)=1-0.91=0.09,平衡常数K=![]() ,设0.1mol/L的HA溶液中c(H+)=amol/L,则K=
,设0.1mol/L的HA溶液中c(H+)=amol/L,则K=![]() ,解得a约为10-3.5mol/L,pH约为3.5,故B正确;
,解得a约为10-3.5mol/L,pH约为3.5,故B正确;
C. z点滴定分数为1,即恰好完全反应,此时溶液中溶质为NaA,根据电荷守恒可知![]() ,此时溶液呈碱性,即氢氧根浓度大于氢离子浓度,所以
,此时溶液呈碱性,即氢氧根浓度大于氢离子浓度,所以![]() ,故C正确;
,故C正确;
D. x点处的溶液中溶质为HA和NaA,且二者物质的量相等,存在电荷守恒:![]() ,物料守恒:
,物料守恒:![]() ;二式消掉钠离子可得:
;二式消掉钠离子可得:![]() ,此时溶液呈酸性,即c(H+)> c(OH-),所以
,此时溶液呈酸性,即c(H+)> c(OH-),所以![]() ,故D错误;
,故D错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】有机物P的结构简式为![]() 。下列关于该有机物的说法不正确的是( )
。下列关于该有机物的说法不正确的是( )
A.向有机物P中直接加入银氨溶液,并水浴加热可以发生银镜反应
B.有机物P中以使溴的四氯化碳溶液退色
C.有机物P可以发生中成、水解、酯化、中和、氧化取代反应
D.1mol有机物P最多可以和2mol![]() 反应
反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
【答案】C
【解析】①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,说明溶液中含有0.02mol NH4+,同时产生红褐色沉淀为氢氧化铁,说明溶液中含有Fe3+,CO32-与Fe3+会发生双水解而不能大量共存,故溶液中一定不含CO32-;②将沉淀过滤、洗涤、灼烧,得到1.6 g固体为氧化铁,则n[Fe(OH)3]=2n(Fe2O3)=2×![]() =0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)=
=0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)= ![]() =0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
=0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
【题型】单选题
【结束】
8
【题目】根据要求回答下列问题:
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列图像说明该反应进行到t1时刻未达平衡状态的是________(填选项字母)。
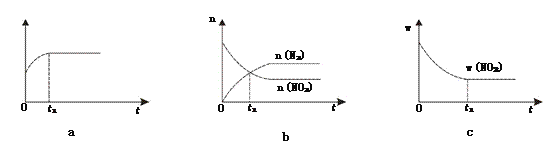
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。
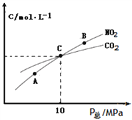
图中A、B、C三点NO2的转化率最高的是_____,该反应的平衡常数Kp=_______(Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
物质 | H2CO | H2S | HNO2 |
电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
②25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
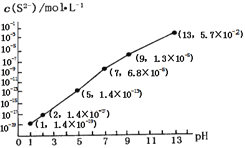
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
则:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 还原铁的氧化物并确定其组成的装置如图所示
还原铁的氧化物并确定其组成的装置如图所示![]() 粒中往往含有硫化物等杂质,焦性没食子酸溶液可吸收少量氧气
粒中往往含有硫化物等杂质,焦性没食子酸溶液可吸收少量氧气![]() 。
。
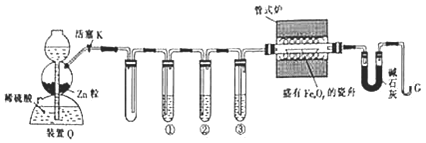
回答下列问题:
![]() 装置
装置![]() 启普发生器
启普发生器![]() 用于制备
用于制备![]() ,还可用于______
,还可用于______![]() 填字母,下同
填字母,下同![]() 。
。
A.生石灰与浓氨水制![]() B.过氧化钠与水制
B.过氧化钠与水制![]()
C.硫化铁固体与稀硝酸制![]() 大理石与稀盐酸制
大理石与稀盐酸制![]()
![]() 中依次盛装的试剂为______,
中依次盛装的试剂为______,![]() 酸性溶液中发生反应的离子方程式为______。
酸性溶液中发生反应的离子方程式为______。
A.![]() 酸性溶液、浓
酸性溶液、浓![]() 、焦性没食子酸溶液
、焦性没食子酸溶液
B.焦性没食子酸溶液、浓![]() 、
、![]() 酸性溶液
酸性溶液
C.![]() 酸性溶液、焦性没食子酸溶液、浓
酸性溶液、焦性没食子酸溶液、浓![]()
![]() “加热管式炉”和“打开活塞K”这两步操作应该先进行的是___,在这两步之间还应进行的操作是___。
“加热管式炉”和“打开活塞K”这两步操作应该先进行的是___,在这两步之间还应进行的操作是___。
![]() 反应过程中G管逸出的气体是______,其处理方法是______。
反应过程中G管逸出的气体是______,其处理方法是______。
![]() 结束反应时,应该______,待装置冷却后称量并记录相应数据。
结束反应时,应该______,待装置冷却后称量并记录相应数据。
![]() 假设反应完全后瓷舟中的固体只有Fe单质,实验中测得了下列数据:
假设反应完全后瓷舟中的固体只有Fe单质,实验中测得了下列数据:![]() 瓷舟的质量为
瓷舟的质量为![]() ;
;![]() 瓷舟和FexOy的总质量为
瓷舟和FexOy的总质量为![]() ;
;![]() 反应前U形曾及内盛物的总质量为
反应前U形曾及内盛物的总质量为![]() ;
;![]() 反应后U形管及内盛物的总质成为
反应后U形管及内盛物的总质成为![]() 。由以上数据计算并确定该铁的氧化物的化学式为______。
。由以上数据计算并确定该铁的氧化物的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池。钒电池电能以化学能的方式存储在不同价态钒离子的硫酸电解液中,通过外接泵把电解液压入电池堆体内,在机械动力作用下,使其在不同的储液罐和半电池的闭合回路中循环流动,采用质子交换膜作为电池组的隔膜,电解质溶液流过电极表面并发生电化学反应,进行充电和放电。下图为全钒液流电池放电示意图:
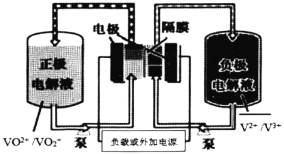
下列说法正确的是( )
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.该电池的储能容量,可以通过增大电解液存储罐的容积并增加电解液的体积来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃在标准状况下的密度为3.215 g/L,现取3.6 g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4 g,碱石灰增重11 g,求:
(1)该烃分子的摩尔质量。
(2)确定该烃的分子式。
(3)已知该烃的一氯代物只有一种,写出该烃的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是
A.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1>-197 kJ·mol-1
B.Q1=Q2=Q3=197kJ
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(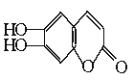 碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
A. 3mol Br22mol NaOH B. 3mol Br24mol NaOH
C. 2mol Br23mol NaOH D. 4mol Br24mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是_______。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有_______。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
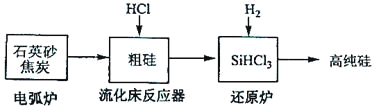
发生的主要反应 | |
电弧炉 | SiO2+2C |
流化床反应器 | Si+3HCl |
还原炉 | SiHCl3+H2 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为_______;碳化硅又称_______,其晶体结构与_______相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为_______。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com