
【题目】硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是_______。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有_______。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
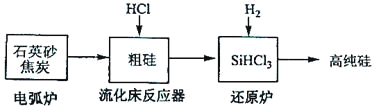
发生的主要反应 | |
电弧炉 | SiO2+2C |
流化床反应器 | Si+3HCl |
还原炉 | SiHCl3+H2 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为_______;碳化硅又称_______,其晶体结构与_______相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为_______。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是_______。
【答案】含有硅、碳的铁合金(或硅铁) 石英砂、纯碱和石灰石 SiO2+3C![]() SiC+2CO↑ 金刚砂 金刚石(或单晶硅) 精馏(或蒸馏) H4SiO4(或H2SiO3)、H2、HCl H2、HCl
SiC+2CO↑ 金刚砂 金刚石(或单晶硅) 精馏(或蒸馏) H4SiO4(或H2SiO3)、H2、HCl H2、HCl
【解析】
(1)石英砂是SiO2,在高温下和木炭发生反应:2C+SiO2![]() 2CO↑+Si,然后硅和铁形成合金,或者是硅、铁、过量的碳形成合金;
2CO↑+Si,然后硅和铁形成合金,或者是硅、铁、过量的碳形成合金;
(2)制造普通玻璃的原料:石英砂、石灰石、纯碱,高温下SiO2+CaCO3![]() CaSiO3+CO2,SiO2+Na2CO3
CaSiO3+CO2,SiO2+Na2CO3![]() Na2SiO3+CO2;
Na2SiO3+CO2;
(3)①根据信息,在高温下,C和二氧化硅反应生成硅单质,硅单质再和C反应生成碳化硅,故:3C+SiO2![]() SiC+2CO,碳化硅俗名金刚砂,属于原子晶体,碳和硅属于同一主族,晶体结构与金刚石或晶体硅相似;
SiC+2CO,碳化硅俗名金刚砂,属于原子晶体,碳和硅属于同一主族,晶体结构与金刚石或晶体硅相似;
②沉降、冷凝后成分是:SiHCl3、SiCl4、SiH2Cl2,都是液体,因此采用蒸馏的方法提纯,水解的反应方程式:SiHCl3+H2O=H2SiO3↓+HCl+H2↑,故H2SiO3、H2、HCl;
(4)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,根据发生的主要反应,可以提供H2、HCl。
2NaOH+H2↑+Cl2↑,根据发生的主要反应,可以提供H2、HCl。


科目:高中化学 来源: 题型:
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
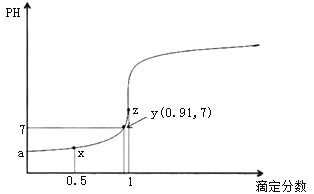
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
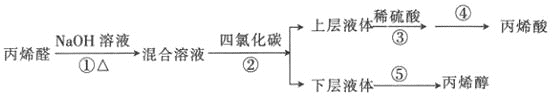
【题目】丙烯酸是合成丙烯酸脂的原料,丙烯醇用于生产甘油、塑料等。某小组以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:
 已知反应原理:
已知反应原理:![]()
![]()
有关物质的物理性质如表:
| 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | -87 | -129 | 13 | -22.8 |
密度/gcm-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和 有机物 | 溶于水和 有机溶剂 | 溶于水和 有机溶剂 | 难溶于水, 易溶于有机物 |
(1)已知苯的沸点为80.1℃,上述步骤②的萃取剂用四氯化碳而不用苯,其主要原因可能是_________________。上层液体分液漏斗________(填“上”或“下”)口倒(或放)出。
(2)从步骤④的残留液中可提取一种无水正盐,它是________(填化学式)。
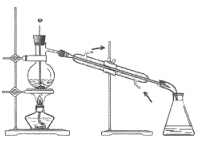
(3)步骤⑤采用如图装置,该装置有一处明显错误,请指出错误:________,并改之。收集丙烯醇的温度应控制在________左右。
(4)已知:醛类具有较强还原性,能与溴水、酸性高锰酸钾溶液、银氨溶液等反应。某同学为了证明丙烯酸产品中含有丙烯醛,设计如下方案:
a.取少量溴水于试管,加入适量丙烯酸样品,振荡,溶液褪色
b.取少量酸性高锰酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液褪色
c.取少量银氨溶液于试管,加入适量丙烯酸样品,用水浴加热,有银镜产生
d.取少量酸性重铬酸钾溶液于试管,加入适量丙烯酸样品,振荡,溶液由橙红色变成绿色
上述方案中,能证明丙烯酸产品中含少量丙烯醛的是________(填字母)。
(5)请你选择下列药品设计一个简单实验证明丙烯醇含有碳碳双键:________。(可选药品:丙烯醇样品、酸性高锰酸钾溶液、酸性重铬酸钾溶液、溴的四氯化碳溶液和钠粒)
(6)为了证明丙烯酸是弱酸,设计如下方案,其中能达到实验目的的是________(填字母)。
代号 | 方案 | 预测现象 |
A | 取少量 | 溶液变红色 |
B | 常温下,将10ml0.1molL-1NaOH溶液和10ml0.1molL-1 | pH>7 |
C | 用相同的导电仪分别测定盐酸溶液、 | 前者灯泡较亮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用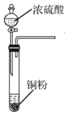 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用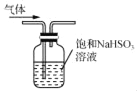 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用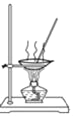 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酰氯(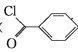 )是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
)是制备染料,香料药品和树脂的重要中间体,以光气法制备苯甲酰氯的原理如下(该反应为放热反应):
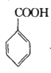 +COCl2
+COCl2![]()
![]() +CO2+HCl
+CO2+HCl
已知物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯甲酸 | 122.1 | 249 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 |
碳酰氯(COCl2) | -188 | 8.2 | 较易溶于苯、甲苯等。遇水迅速水解,生成氯化氢,与氨很快反应,主要生成尿素[CO(NH2)2]和氯化铵等无毒物质 |
苯甲酰氯 | -1 | 197 | 溶于乙醚、氯仿和苯。遇水或乙醇逐渐分解,生成苯甲酸或苯甲酸乙酯和氯化氢 |
三氯甲烷(CHCl3) | -63.5 | 63.1 | 不溶于水,溶于醇、苯。极易挥发,稳定性差,450℃以上发生热分解 |
I.制备碳酰氯
反应原理:2 CHCl3+O2![]() 2HCl+COCl2
2HCl+COCl2
甲. 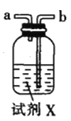 乙.
乙. 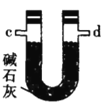 丙.
丙. 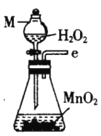 丁.
丁.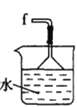 戊.
戊. 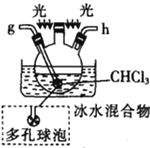
(1)仪器M的名称是____________
(2)按气流由左至右的顺序为___________→c→d→_________→_________→_________→_________→_________.
(3)试剂X是_______________(填名称)。
(4)装置乙中碱石灰的作用是____________。
(5)装置戊中冰水混合物的作用是____________;多孔球泡的作用是________________。
Ⅱ.制备苯甲酰氯(部分夹持装置省略)
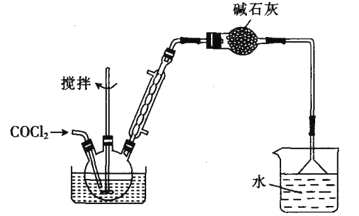
(6)碳酰氯也可以用浓氨水吸收,写出该反应的化学方程式:______________。
若向三颈烧瓶中加入610g苯甲酸,先加热至140~150℃,再通入COCl2,充分反应后,最后产品经减压蒸馏得到562g苯甲酰氯,则苯甲酸的转化率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用呋喃甲醛为原料制备呋喃甲醇与呋喃甲酸。
Ⅰ、制备原理:
2![]() +NaOH
+NaOH![]() +
+![]()
![]() +HCl
+HCl![]() +NaCl
+NaCl
Ⅱ、实验步骤
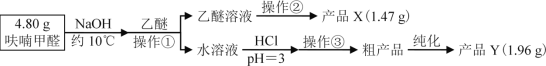
Ⅲ、相关信息
呋喃甲醛 | 呋喃甲醇 | 呋喃甲酸 | 乙醚 | |
熔点/℃ | -36.5 | -29 | 133 | -116.3 |
沸点/℃ | 161.7 | 170 | 231 | 34.5 |
水溶性 | 微溶 | 微溶 | 可溶 | 不溶 |
相对分子质量 | 96 | 98 | 112 | 74 |
Ⅳ、实验装置
V、分析与思考,回答下列问题:
(1)操作①名称___
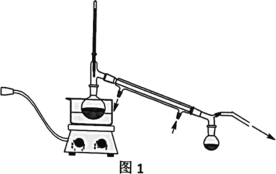
(2)操作②的装置如图1所示,收集产品X时温度计的读数应控制在90℃左右,其原因是___。
(3)操作①所得水溶液,加盐酸须控制pH为2~3,pH<3的理由是___;控制溶液pH时,应选择的指示剂是__。
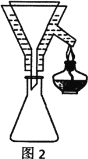
(4)粗产品Y纯化过程用图2装置进行热过滤,具体操作:向铜漏斗中加热水→___→拆装置。涉及操作顺序最合理的选项。
A.加热漏斗支管→放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液
B.放入短颈漏斗→放接液烧杯→加热漏斗支管→放入滤纸→倒入热的待滤液
C.放入短颈漏斗→放入滤纸→加热漏斗支管→放接液烧杯→倒入热的待滤液
D.放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液→加热漏斗支管
(5)共消耗30mL萃取剂乙醚,从萃取效果角度思考,下列4种萃取方式最合理的是__。
A.30mL、0mL、0mL B.10mL、10mL、10mL
C.15mL、10mL、5 mL D.5mL、10mL、15mL
(6)计算产品Y的产率ω(Y)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述或书写正确的是
A. H2(g)+F2 (g)===2HF(g) △H=-270 kJ·mol -1,则相同条件下,2mol HF气体的能量大于1mol氢气和1mol氟气的能量之和
B. 2H2(g)+O2(g)===2H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热大于241.8kJ.mol-1
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该中和反应的热化学方程式为NaOH+HCl===NaCl+H2O △H =-57.4kJ·mol-1
D. 500℃、30MPa时,发生反应N2(g)+3H2(g) ![]() 2NH3(g) △H =-38.6kJ·mol-1在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
2NH3(g) △H =-38.6kJ·mol-1在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应常伴有能量变化,不同反应能量转化方式不同,下列有关说法正确的是
A.甲醇(CH4O)碱性(KOH)燃料电池负极反应式:CH4O–6e-+8OH-=![]() +6H2O
+6H2O
B.已知键能H-H:akJ/mol、键能H-O:bkJ/mol、O=O键能:ckJ/mol,则能表示H2的燃烧热的化学反应方程式为:H2(g)+O2(g)=H2O(l)![]() H=-(2b-a-0.5c)kJ/mol
H=-(2b-a-0.5c)kJ/mol
C.能表示稀硫酸与稀氢氧化钡溶液反应中和热离子方程式为:H+(aq)+OH-(aq)=H2O(l)![]() H=-57.3kJ/mol
H=-57.3kJ/mol
D.锂电池反应:LixC6+Li1-XFePO4![]() LiFePO4+6C,则充电时阳极反应式为:Li1-XFePO4-xe-+xLi+=LiFePO4
LiFePO4+6C,则充电时阳极反应式为:Li1-XFePO4-xe-+xLi+=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 溶液与
溶液与![]() 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题
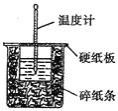
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是__________________。
(2)烧杯间填满碎纸条的作用是__________________。
(3)实验数据如下表:
温度 实验 次数 | 起始温度 | 终止温度 | 温度差平均值 | ||
| KOH | 平均值 | |||
1 |
|
|
|
| |
2 |
|
|
|
| |
3 |
|
|
|
| |
4 |
|
|
|
| |
![]() 本次实验的温度差的平均值
本次实验的温度差的平均值![]() _________
_________![]() 。
。
![]() 近似地认为
近似地认为![]() 溶液和
溶液和![]() 溶液的密度都是
溶液的密度都是![]() ,中和后生成溶液的比热容
,中和后生成溶液的比热容![]() ,则中和热
,则中和热![]() _________
_________![]() 数值精确到
数值精确到![]() 。
。
![]() 中和热测定实验中,下列操作一定会降低实验准确性的是_________。
中和热测定实验中,下列操作一定会降低实验准确性的是_________。
![]() 用滴定管
用滴定管![]() 精量仪器,读数保留到
精量仪器,读数保留到![]() 取所用酸碱溶液的体积
取所用酸碱溶液的体积
![]() 溶液在倒入小烧杯时,有少量溅出
溶液在倒入小烧杯时,有少量溅出
![]() 大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
![]() 测量
测量![]() 溶液的温度计用水洗净后才用来测KOH溶液的温度
溶液的温度计用水洗净后才用来测KOH溶液的温度
(4)实验中改用![]() 盐酸跟
盐酸跟![]() 溶液进行反应,与上述实验相比,所放出的热量_________
溶液进行反应,与上述实验相比,所放出的热量_________![]() 填“相等”或“不相等”
填“相等”或“不相等”![]() ,所求中和热_________
,所求中和热_________![]() 填“相等”或“不相等”
填“相等”或“不相等”![]() 。
。
(5)若用![]() 溶液进行上述实验,测得的中和热的数值会_________
溶液进行上述实验,测得的中和热的数值会_________![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com