
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用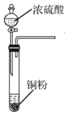 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用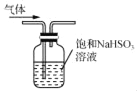 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用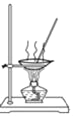 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
【答案】D
【解析】
A. 可用分液的方法分离互不相溶的液体;
B. Cu和浓H2SO4反应需要加热;
C. 亚硫酸氢根离子已经饱和,无法除去二氧化硫;
D. 蒸发结晶的方法得到NaCl晶体
A. I2易溶于CCl4,不能用分液的方法分离,故A项错误;
B. 获取少量SO2气体,可采用铜粉与浓硫酸加热的方法制得,但图示未有加热装置,不能达到实验目的,故B项错误;
C. 二氧化硫溶于水形成亚硫酸,可弱电离生成HSO3-和H+,而饱和NaHSO3溶液中HSO3-已经饱和,则不能溶解SO2,不能达到实验目的,故C项错误;
D.采用蒸发结晶法可从NaCl溶液获得NaCl晶体,图示操作无误,故D项正确;
答案选D。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A和1 mol B两种气体混合于容积为2 L的密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(s)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol/L。下列判断正确的是( )
xC(g)+2D(s)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol/L。下列判断正确的是( )
A. 该条件下此反应的平衡常数约为0.91
B. 2 min内A的平均反应速率为0.3 mol/(L·s)
C. B的转化率为60%
D. 混合气体的密度不再改变时,该反应不一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求回答问题:


(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置的字母,下同)
(2)从油水混合物中分离出植物油,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,水的方向是从________口进水_______口出水。
(4)装置B在分液时打开活塞后,下层液体从________,上层液体从________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CH3OH(g)+H2O(g) △H1=-53.7kJmol-1 I
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2 II
CO(g)+H2O(g) △H2 II
某实验室控制CO2和H2初始投料比为1︰2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJmol-1和-285.8kJmol-1。
②H2O(l)=H2O(g) △H3=+44.0kJmol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=______;反应II的△H2=______kJmol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有__________。
A.使用催化剂Cat.1 B.使用催化剂Cat.2
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大 CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___________________________。
(4)在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图_________。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究外界条件对锌与稀硫酸反应速率的影响,设计如下方案:
编号 | 纯锌粉 | 0. 2 mol·L-1硫酸溶液 | 温度 | 硫酸铜固体 |
Ⅰ | 2. 0 g | 200. 0 mL | 25 ℃ | 0 |
Ⅱ | 2. 0 g | 200. 0 mL | 35 ℃ | 0 |
Ⅲ | 2. 0 g | 200. 0 mL | 35 ℃ | 0. 2 g |
下列叙述不正确的是
A. Ⅰ和Ⅱ实验探究温度对反应速率的影响
B. Ⅱ和Ⅲ实验探究原电池对反应速率的影响
C. 反应速率Ⅲ>Ⅱ>Ⅰ
D. 实验Ⅰ、Ⅱ、Ⅲ的变化图象如图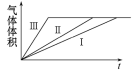
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质沸点由高到低的顺序是
①正丁烷 ②2—甲基丙烷 ③丙烷 ④2,2—二甲基丙烷
A. ④②①③B. ④①②③C. ②④①③D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分类如图所示:

由图判断下列说法中不正确的是( )
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.碱性氧化物一定是金属氧化物
D.非金属氧化物一 定是酸性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com