
����Ŀ��ʵ��������ૼ�ȩΪԭ���Ʊ�ૼ״���ૼ��ᡣ
���Ʊ�ԭ����
2![]() ��NaOH
��NaOH![]() ��
��![]()
![]() ��HCl
��HCl![]() ��NaCl
��NaCl
��ʵ�鲽��
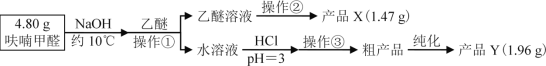
�������Ϣ
ૼ�ȩ | ૼ״� | ૼ��� | ���� | |
�۵�/�� | ��36.5 | ��29 | 133 | ��116.3 |
�е�/�� | 161.7 | 170 | 231 | 34.5 |
ˮ���� | �� | �� | ���� | ���� |
��Է������� | 96 | 98 | 112 | 74 |
����ʵ��װ��
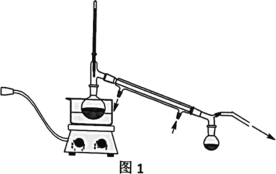
V��������˼�����ش��������⣺
��1������������___
��2�������ڵ�װ����ͼ1��ʾ���ռ���ƷXʱ�¶ȼƵĶ���Ӧ������90�����ң���ԭ����___��
��3������������ˮ��Һ�������������pHΪ2��3��pH��3��������___��������ҺpHʱ��Ӧѡ���ָʾ����__��
��4���ֲ�ƷY����������ͼ2װ�ý����ȹ��ˣ������������ͭ©���м���ˮ��___����װ�á��漰����˳���������ѡ�
A������©��֧��������̾�©����������ֽ���Ž�Һ�ձ��������ȵĴ���Һ
B������̾�©�����Ž�Һ�ձ�������©��֧����������ֽ�������ȵĴ���Һ
C������̾�©����������ֽ������©��֧�����Ž�Һ�ձ��������ȵĴ���Һ
D������̾�©����������ֽ���Ž�Һ�ձ��������ȵĴ���Һ������©��֧��
��5��������30mL��ȡ�����ѣ�����ȡЧ���Ƕ�˼��������4����ȡ��ʽ���������__��
A��30mL��0mL��0mL B��10mL��10mL��10mL
C��15mL��10mL��5 mL D��5mL��10mL��15mL
��6�������ƷY�IJ�����(Y)��___��
���𰸡���ȡ��Һ ૼ��� ��ѹ�����ૼ״��е㽵�ͣ�����170��(Լ90��)ʱ�����ռ�����ֹ�¶ȹ�������ૼ״��ṹ�ƻ� ����pH��3��ʹૼ�������ȫת��Ϊૼ�������� ����(��չ���) A B 70%
��������
ૼ�ȩ�ڼ��������·����绯��Ӧ����![]() ��
��![]() ��
��![]() ���������ѣ�����������ȡ��Һ���õ�
���������ѣ�����������ȡ��Һ���õ�![]() ��������Һ��
��������Һ��![]() ��ˮ��Һ��
��ˮ��Һ��![]() ������������õ�
������������õ�![]() ��
��![]() ��ˮ��Һ�������ᣬ����pH=3������
��ˮ��Һ�������ᣬ����pH=3������![]() �����������ؽᾧ���ᴿ
�����������ؽᾧ���ᴿ![]() ��
��
�������Ϸ�������1���������Ǽ������ѣ�����![]() ��������Һ��
��������Һ��![]() ��ˮ��Һ��������ȡ��Һ��
��ˮ��Һ��������ȡ��Һ��![]() ��ˮ��Һ�������ᣬ����pH=3������
��ˮ��Һ�������ᣬ����pH=3������![]() ���������Բ�ƷYΪૼ��ᡣ
���������Բ�ƷYΪૼ��ᡣ
��2��������Ϊ����װ�ã���ֹ�¶ȹ�������ૼ״��ṹ�ƻ���ͨ����ѹ�����ૼ״��е㽵�ͣ�����170��(Լ90��)ʱ�����ռ�ૼ״��������¶ȼƵĶ���Ӧ������90�����ҡ�
��3������������ˮ��Һ���������ᣬ����pH��3��ʹૼ�������ȫת��Ϊૼ��������������Ҫ����pH��3��������pH��3.1ʱ���ʺ�ɫ�����Կ�����ҺpHʱӦѡ�������ָʾ����
��4��Ϊ��ֹૼ���ᾧ�������ֲ�ƷY�����������ȹ��ˣ������������ͭ©���м���ˮ������©��֧��������̾�©����������ֽ���Ž�Һ�ձ��������ȵĴ���Һ����װ�á���ѡA��
��5������ȡЧ���Ƕ�˼������30mL��ȡ�����ѣ���÷ֶ�ε�����ȡ���ϲ���ȡҺ����ѡB��
��6��ૼ�ȩ�����ʵ�����![]() ������2
������2![]() ��NaOH
��NaOH![]() ��
��![]() ��
��![]() ��HCl
��HCl![]() ��NaCl������ૼ�������۲�����0.025mol��������0.025mol��112g/mol=2.8g��ʵ������ૼ����������1.96g����ƷY�IJ�����(Y)��
��NaCl������ૼ�������۲�����0.025mol��������0.025mol��112g/mol=2.8g��ʵ������ૼ����������1.96g����ƷY�IJ�����(Y)��![]() 70%��
70%��


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ڱ�״���µ��ܶ�Ϊ3.215 g/L����ȡ3.6 g������ȫȼ�գ���ȫ����������ͨ��������Ũ����ͼ�ʯ�ң�Ũ��������5.4 g����ʯ������11 g����
��1���������ӵ�Ħ��������
��2��ȷ�������ķ���ʽ��
��3����֪������һ�ȴ���ֻ��һ�֣�д�������Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������A��E��������Aԭ�Ӻ���ֻ��һ�����ӣ���֪B��Dԭ������ͬ�ĵ��Ӳ�������B��L���������K���������������E�ڿ�����ȼ��ʱ���ֻ�ɫ���棬E�ĵ����ڼ�������D�ĵ��ʳ�ַ�Ӧ�����Եõ�����ɫ��̬������Ը������������ش�
(1)д��Ԫ��C�����ڱ���λ��________________
(2)E�ĵ����ڼ�������D�ĵ��ʳ�ַ�Ӧ�����Եõ�����ɫ��̬������ĵ���ʽ_________________
(3)C���⻯��������ۺ����ᷴӦ�Ļ�ѧ����ʽ�������������ӵĵ���ʽ__________��__________
(4)B��C��D���⻯����ȶ��Ե��ɴ�С��˳��Ϊ��___________(�⻯��Ļ�ѧʽ)�������ǣ�________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���������������������·�Ӧ��2SO2(g)+ O2 (g) ![]() 2SO3(g) ��H< 0����������֪��SO3�۵�16.83�����е�44.8����
2SO3(g) ��H< 0����������֪��SO3�۵�16.83�����е�44.8����
��1��600��ʱ����һ�ݻ�Ϊ2 L���ܱ������У������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ��
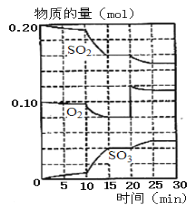
����ͼ�жϣ��÷�Ӧ����ƽ��״̬��ʱ����_______��
������600���£��÷�Ӧ�Ļ�ѧƽ�ⳣ�� K=_______��
����ͼ�жϣ���Ӧ������20 minʱ�����߷����仯��ԭ����________________(�����ֱ���)��
��2��ij��ѧ�о�ѧϰС������ͼ��װ����װ�����һ��ʵ�飬�ԲⶨSO2ת��ΪSO3��ת���ʣ�����������˳����a��h��i��b��c��f��g��d��e��
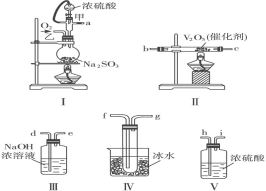
��Ϊ���SO2��ת���ʣ�ʵ��ʱ��������Ũ�������������ȴ������Ⱥ�˳����____��
���������ô�������ƿʱSO2��ת���ʻ�_______��(ѡ������������������������С��)
����n mol Na2SO3��ĩ������Ũ������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ��Ƶ��������� m g����ʵ����SO2��ת����Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڵؿ��еĺ����ϸߡ��輰�仯����Ŀ��������Ѿã����ִ��������й㷺Ӧ�á��ش��������⣺
��1��1810����仯ѧ�ұ�������˹�ڼ���ʯӢɰ��ľ̿����ʱ���õ�һ������������������������������_______��
��2���մɡ�ˮ��Ͳ����dz��õĹ����β��ϡ����У�������ͨ��������Ҫԭ����_______��
��3���ߴ������ִ���Ϣ���뵼��������Ȳ�ҵ����Ҫ�Ļ������ϡ���ҵ���ᴿ���ж���·�ߣ�����һ�ֹ�������ʾ��ͼ����Ҫ��Ӧ���£�
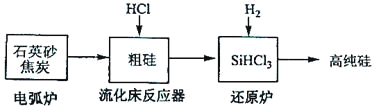
��������Ҫ��Ӧ | |
�绡¯ | SiO2+2C |
��������Ӧ�� | Si+3HCl |
��ԭ¯ | SiHCl3+H2 |
����ʯӢɰ�ͽ�̿�ڵ绡¯�и��¼���Ҳ��������̼���裬�÷�Ӧ�Ļ�ѧ����ʽΪ_______��̼�����ֳ�_______���侧��ṹ��_______���ơ�
������������Ӧ�IJ����У�SiHCl3��Լռ85%������SiCl4��SiH2Cl2��SiH3Cl�ȣ��й����ʵķе��������±����ᴿSiHCl3����Ҫ���ղ��������dz�����������_______��
���� | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
�е�/�� | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
��SiHCl3����ˮ�⣬����ȫˮ��IJ���Ϊ_______��
��4���ȼҵ��Ϊ�������������ṩ����ԭ�ϣ���Щԭ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na��Al��Fe��Cu����ѧ��ѧ����Ҫ�Ľ���Ԫ�ء����ǵĵ��ʼ��仯����֮���кܶ�ת����ϵ���±��������ʲ��ܰ���ͼ(��������ʾһ�����)��ϵ�ת������
ѡ�� | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ˮ�ĵ���ƽ��������ͼ��ʾ���Իش��������⣺
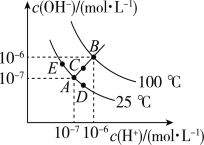
��1��ͼ��ABCDE����KW��Ĵ�С��ϵ��___________������ABCDE��ʾ��
��2������A�㵽D�㣬�ɲ��õĴ�ʩ��______��
a������
b����������������
c������������NaOH����
��3����B��Ӧ�¶������£�ij��ҺpH�T7����ʱ����Һ��____�����ԡ����ԡ����ԣ�����E��Ӧ���¶��£���pH=9��NaOH��Һ��pH=4��H2SO4��Һ��ϣ������û����Һ��pH=7����NaOH��Һ��H2SO4��Һ�������Ϊ________��
��4����B��Ӧ���¶��£���100���pH1=a��ijǿ����Һ��1���pH2=b��ijǿ����Һ��Ϻ���Һ�����ԣ�����ǰ����ǿ���pH1��ǿ���pH2֮��Ӧ����Ĺ�ϵ��pH1+ pH2= ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ʼŨ��Ϊ0.1mol.L-1����������Һ�У�H2SO3��HSO3-��SO32-�����������ʵ��������������������ʵ������������������ʵ���֮�ȣ���pH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
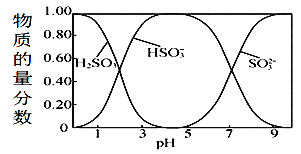
A.��ȡͼ�����ݼ���ɵõ���������������Һ��Ka2��10-7
B.�����ϵ�м���һ������NaOH���壬HSO3-�����ʵ�������һ������
C.��pH=1.0��Һ�У�c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.�ڸ���ϵ�е�����һ�㶼���ڣ�c2(H+)=c(H+)��c(HSO3-)+2c(H+)c(SO32-)+Kw
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/LNaOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1mol/LHCl��Һ��HX��Һ����Һ��pH������NaOH��Һ����仯��ͼ������˵����ȷ����
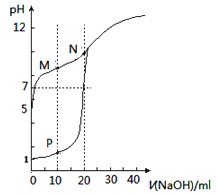
A. M��c(HX)-c(X-)>c(OH-)-c(H+)
B. N���pH>7��ԭ��������NaOH��������
C. HXΪ���ᣬ�ҵ���ƽ�ⳣ��Ka��1��10-10
D. P��c(Cl-)=0.05mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com