
【题目】已知水的电离平衡曲线如图所示,试回答下列问题:
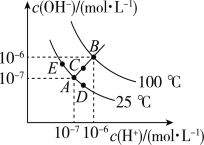
(1)图中ABCDE五点的KW间的大小关系是___________.(用ABCDE表示)
(2)若从A点到D点,可采用的措施是______.
a.升温
b.加入少量的盐酸
c.加入少量的NaOH固体
(3)点B对应温度条件下,某溶液pH═7,此时,溶液呈____(酸性、碱性、中性),点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2= ___________.
【答案】B>C>A=D=E b 碱性 10:1 14
【解析】
(1)Kw只与温度有关,温度升高促进水的电离,据此分析;
(2)仔细观察图像,溶液由A点中性转化为D点酸性,据此分析;
(3)25℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH-)=n(H+),据此分析;
(4)温度为100℃,水的离子积为10-12,由于反应后溶液呈中性,所以n(OH-)=n(H+),据此分析。
(1)Kw只与温度有关,温度升高促进水的电离,Kw增大,因此有B>C>A=D=E;综上所述,本题答案是:B>C>A=D=E。
(2)从A点到D点,溶液由中性转化为酸性,因此选项b与题意相符;综上所述,本题选b。
(3)点B对应温度为100℃,Kw=10-12,pH=6,溶液为中性;温度不变时,某溶液pH=7,此时,溶液呈碱性;点E对应温度为25℃,Kw=10-14,25℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)×10-5mol/L=V(H2SO4)×10-4mol/L,得V(NaOH):V(H2SO4)=10:1;综上所述,本题答案是:碱性,10:1。
(4)点B对应的温度为100℃,水的离子积常数为10-12,pH=b的某强碱溶液中c(OH-)=10b-12,反应后溶液呈中性,所以n(OH-)=n(H+),即100×10-a=1×10b-12,故a+b=14,即pH1+pH2=14;综上所述,本题答案是:14。


科目:高中化学 来源: 题型:
【题目】草酸二甲酯可用作制备维生素B13的中间体,也可用作增塑剂。实验室以草酸![]() 和甲醇为原料制备草酸二甲酯的一种方法如下:
和甲醇为原料制备草酸二甲酯的一种方法如下:![]()
![]()
![]() 。
。
相关物质的有关数据如下表所示:
物质 | 苯 | 甲醇 | 草酸二甲酯 |
熔点/℃ | 5.5 | -97 | 54 |
沸点/℃ | 80.1 | 64.3 | 163.5 |
相对分子质量 | 78 | 32 | 118 |
水溶性 | 不溶 | 互溶 | 不溶 |
实验过程:向如图反应装置中加入27g草酸、40g无水甲醇、100ml苯、5ml浓硫酸,搅拌下加热回流;待反应完全后,分离出甲醇和苯,所得反应液经水洗,有机层再用10%的碳酸钠溶液洗涤,然后用蒸馏水洗涤,加无水氯化钙固体干燥;过滤,滤液冷却后析出晶体,干燥,得草酸二甲酯30.1g。
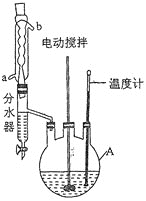
回答下列问题:
(1)仪器A的名称为____________,反应过程中冷却水应从________(填“a”或“b”)口进入。
(2)分离出甲醇和苯的操作名称为______________________________。
(3)用10%的碳酸钠溶液洗涤的目的是____________________________________。
(4)甲醇过量的目的是________________________________________________,浓硫酸的作用是_____________________________________________。
(5)分水器的优点是__________________________________________(任写一点)。
(6)本实验的产率是___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
A. 用 所示装置分离CCl4和I2的混合物
所示装置分离CCl4和I2的混合物
B. 用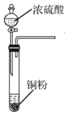 所示装置获取少量SO2气体
所示装置获取少量SO2气体
C. 用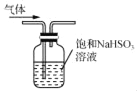 所示装置除去CO2气体中的少量SO2
所示装置除去CO2气体中的少量SO2
D. 用 所示装置蒸发NaCl溶液获得NaCl晶体
所示装置蒸发NaCl溶液获得NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用呋喃甲醛为原料制备呋喃甲醇与呋喃甲酸。
Ⅰ、制备原理:
2![]() +NaOH
+NaOH![]() +
+![]()
![]() +HCl
+HCl![]() +NaCl
+NaCl
Ⅱ、实验步骤
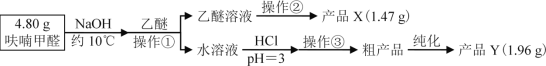
Ⅲ、相关信息
呋喃甲醛 | 呋喃甲醇 | 呋喃甲酸 | 乙醚 | |
熔点/℃ | -36.5 | -29 | 133 | -116.3 |
沸点/℃ | 161.7 | 170 | 231 | 34.5 |
水溶性 | 微溶 | 微溶 | 可溶 | 不溶 |
相对分子质量 | 96 | 98 | 112 | 74 |
Ⅳ、实验装置
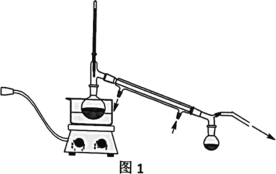
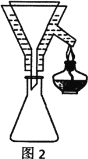
V、分析与思考,回答下列问题:
(1)操作①名称___
(2)操作②的装置如图1所示,收集产品X时温度计的读数应控制在90℃左右,其原因是___。
(3)操作①所得水溶液,加盐酸须控制pH为2~3,pH<3的理由是___;控制溶液pH时,应选择的指示剂是__。
(4)粗产品Y纯化过程用图2装置进行热过滤,具体操作:向铜漏斗中加热水→___→拆装置。涉及操作顺序最合理的选项。
A.加热漏斗支管→放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液
B.放入短颈漏斗→放接液烧杯→加热漏斗支管→放入滤纸→倒入热的待滤液
C.放入短颈漏斗→放入滤纸→加热漏斗支管→放接液烧杯→倒入热的待滤液
D.放入短颈漏斗→放入滤纸→放接液烧杯→倒入热的待滤液→加热漏斗支管
(5)共消耗30mL萃取剂乙醚,从萃取效果角度思考,下列4种萃取方式最合理的是__。
A.30mL、0mL、0mL B.10mL、10mL、10mL
C.15mL、10mL、5 mL D.5mL、10mL、15mL
(6)计算产品Y的产率ω(Y)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述或书写正确的是
A. H2(g)+F2 (g)===2HF(g) △H=-270 kJ·mol -1,则相同条件下,2mol HF气体的能量大于1mol氢气和1mol氟气的能量之和
B. 2H2(g)+O2(g)===2H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热大于241.8kJ.mol-1
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该中和反应的热化学方程式为NaOH+HCl===NaCl+H2O △H =-57.4kJ·mol-1
D. 500℃、30MPa时,发生反应N2(g)+3H2(g) ![]() 2NH3(g) △H =-38.6kJ·mol-1在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
2NH3(g) △H =-38.6kJ·mol-1在此条件下将1.5molH2和过量N2充分反应,放出热量19.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量的不同,溶液M的组成也不同,若向M中加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计CO2的溶解)
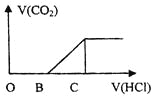
A.若OB=0,则形成溶液M所发生的离子方程式为OH-+CO2=![]()
B.若OB=BC,则溶液M为![]() 溶液
溶液
C.若OB>BC,则溶液M中大量存在的阴离子为![]() 和
和![]()
D.若3OB=BC,则溶液M中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应常伴有能量变化,不同反应能量转化方式不同,下列有关说法正确的是
A.甲醇(CH4O)碱性(KOH)燃料电池负极反应式:CH4O–6e-+8OH-=![]() +6H2O
+6H2O
B.已知键能H-H:akJ/mol、键能H-O:bkJ/mol、O=O键能:ckJ/mol,则能表示H2的燃烧热的化学反应方程式为:H2(g)+O2(g)=H2O(l)![]() H=-(2b-a-0.5c)kJ/mol
H=-(2b-a-0.5c)kJ/mol
C.能表示稀硫酸与稀氢氧化钡溶液反应中和热离子方程式为:H+(aq)+OH-(aq)=H2O(l)![]() H=-57.3kJ/mol
H=-57.3kJ/mol
D.锂电池反应:LixC6+Li1-XFePO4![]() LiFePO4+6C,则充电时阳极反应式为:Li1-XFePO4-xe-+xLi+=LiFePO4
LiFePO4+6C,则充电时阳极反应式为:Li1-XFePO4-xe-+xLi+=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
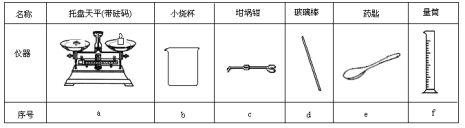
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
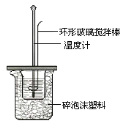
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院在斯德哥尔摩宣布2019年度诺贝尔化学奖授予在锂离子电池的发展方面做出贡献的科学家。锂电池作为最主要的便携式能量源,影响着我们生活的方方面面。锂空气电池放电的工作原理如图所示。下列叙述正确的是( )
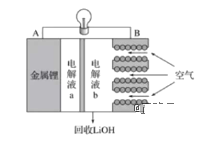
A.电池放电时负极电极方程式为O2+2H2O+4e-=4OH-
B.放电时电子由B极向A极移动
C.电解液a,b之间可采用阴离子交换膜
D.电解液b可能为稀LiOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com