
【题目】化学反应常伴有能量变化,不同反应能量转化方式不同,下列有关说法正确的是
A.甲醇(CH4O)碱性(KOH)燃料电池负极反应式:CH4O–6e-+8OH-=![]() +6H2O
+6H2O
B.已知键能H-H:akJ/mol、键能H-O:bkJ/mol、O=O键能:ckJ/mol,则能表示H2的燃烧热的化学反应方程式为:H2(g)+O2(g)=H2O(l)![]() H=-(2b-a-0.5c)kJ/mol
H=-(2b-a-0.5c)kJ/mol
C.能表示稀硫酸与稀氢氧化钡溶液反应中和热离子方程式为:H+(aq)+OH-(aq)=H2O(l)![]() H=-57.3kJ/mol
H=-57.3kJ/mol
D.锂电池反应:LixC6+Li1-XFePO4![]() LiFePO4+6C,则充电时阳极反应式为:Li1-XFePO4-xe-+xLi+=LiFePO4
LiFePO4+6C,则充电时阳极反应式为:Li1-XFePO4-xe-+xLi+=LiFePO4
【答案】A
【解析】
A.甲醇碱性燃料电池中,甲醇在负极失去电子发生氧化反应,生成的CO2与OH-反应生成![]() 和H2O,电极反应式为CH4O–6e-+8OH-=
和H2O,电极反应式为CH4O–6e-+8OH-=![]() +6H2O,A选项正确;
+6H2O,A选项正确;
B.燃烧热是指1mol可燃物完全燃烧生成稳定化合物所释放的热量,因此H2的燃烧热的化学反应方程式应为:H2(g)+![]() O2(g)=H2O(l),由ΔH=反应物的总键能-生成物的总键能可得,ΔH=-(2b-a-0.5c)kJ/mol,B选项错误;
O2(g)=H2O(l),由ΔH=反应物的总键能-生成物的总键能可得,ΔH=-(2b-a-0.5c)kJ/mol,B选项错误;
C.稀硫酸与稀氢氧化钡溶液反应生成难溶性盐和水,离子反应方程式为Ba2++2OH-+2H++![]() =BaSO4+2H2O,且放出的热量增多,C选项错误;
=BaSO4+2H2O,且放出的热量增多,C选项错误;
D.锂电池反应:LixC6+Li1-XFePO4![]() LiFePO4+6C,则充电时,阳极LiFePO4失去电子,发生还原反应,电极反应式为:LiFePO4-xe-=Li1-XFePO4+xLi+,D选项错误;
LiFePO4+6C,则充电时,阳极LiFePO4失去电子,发生还原反应,电极反应式为:LiFePO4-xe-=Li1-XFePO4+xLi+,D选项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(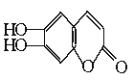 碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
碳氢原子未画出,每个折点表示一个碳原子),具有抗菌作用。若1mol 七叶树内酯,分别与 浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
A. 3mol Br22mol NaOH B. 3mol Br24mol NaOH
C. 2mol Br23mol NaOH D. 4mol Br24mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是_______。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有_______。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
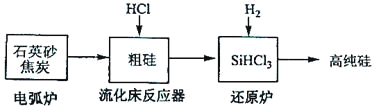
发生的主要反应 | |
电弧炉 | SiO2+2C |
流化床反应器 | Si+3HCl |
还原炉 | SiHCl3+H2 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为_______;碳化硅又称_______,其晶体结构与_______相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为_______。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,试回答下列问题:
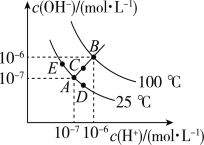
(1)图中ABCDE五点的KW间的大小关系是___________.(用ABCDE表示)
(2)若从A点到D点,可采用的措施是______.
a.升温
b.加入少量的盐酸
c.加入少量的NaOH固体
(3)点B对应温度条件下,某溶液pH═7,此时,溶液呈____(酸性、碱性、中性),点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2= ___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯和其他无机原料合成化合物E,转化关系如图:
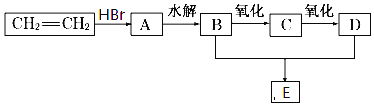
(1)写出下列物质的结构简式:B.______D.______E______
(2)写出有机物C与银氨溶液的反应方程:______
(3)![]() 的化学方程:______
的化学方程:______
(4)若把线路中转化关系中的HBr变成![]() 则E的结构简式______。
则E的结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是
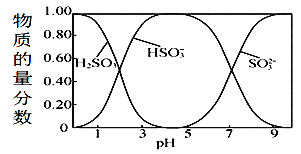
A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向该体系中加入一定量的NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)c(SO32-)+Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题小组合成了一种复合材料的基体M的结构简式为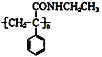 ,合成路线如下
,合成路线如下
![]()
已知:R—CN![]() R—COOH
R—COOH
请回答下列问题:
![]() 有机物C分子结构中含有的官能团有______________。
有机物C分子结构中含有的官能团有______________。
![]() 写出A的结构简式 _________________。
写出A的结构简式 _________________。
![]() 反应①、②的反应类型分别为 _______________、 ________________。
反应①、②的反应类型分别为 _______________、 ________________。
![]() 写出反应③的化学方程式 ________________。
写出反应③的化学方程式 ________________。
![]() 写出符合下列条件:①能使
写出符合下列条件:①能使![]() 溶液显紫色;②只有二个取代基;③与新制的
溶液显紫色;②只有二个取代基;③与新制的![]() 悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。根据以上信息回答下列问题:
(1)B、C、G的氢化物中稳定性最强的是__________(填化学式),G的某种氧化物能使溴水褪色,写出该反应的化学方程式__________________________________________。
(2)B、C、D、E、F形成的简单离子半径由大到小的顺序为__________________(用离子符号表示)。
(3)A与B能形成离子化合物A5B,A5B中既含离子键又含共价键,其电子式为________,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是__________。
(4)D、A、C和碳元素组成的化合物的水溶液呈________性,用离子方程式解释其原因________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物M的合成路线如下:
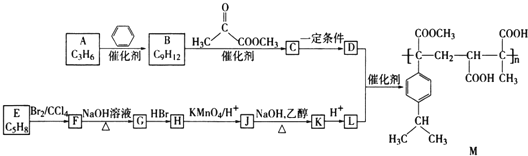
已知:R-CH2OH![]() R-COOH表示饱和烃基
R-COOH表示饱和烃基![]() 回答下列问题:
回答下列问题:
(1)![]() 的反应类型是 ______ .
的反应类型是 ______ .
(2)![]() 的反应条件为 ______ .
的反应条件为 ______ .
(3)![]() 可以使溴的四氯化碳溶液褪色,则E的系统命名是 ______ .
可以使溴的四氯化碳溶液褪色,则E的系统命名是 ______ .
(4)设计反应![]() 和
和![]() 的目的是 ______ .
的目的是 ______ .
(5)![]() 有两种可能的结构,为了确定其结构可选用的仪器是 ______
有两种可能的结构,为了确定其结构可选用的仪器是 ______ ![]() 填代号
填代号![]() .
.
![]() 红外光谱仪
红外光谱仪![]() 质谱仪
质谱仪![]() 元素分析仪
元素分析仪![]() 核磁共振仪
核磁共振仪
(6)高分子化合物M的单体为 ______ ![]() 写结构简式
写结构简式![]() .
.
(7)![]() 的化学方程式为 ______ .
的化学方程式为 ______ .
(8)与L具有相同官能团的L的同分异构体还有 ______ 种,其中核磁共振氢谱为3组峰,且面积比为3:2:1的是 ______ ![]() 写结构简式
写结构简式![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com