
【题目】下列有关说法正确的是![]()
A.已知![]() 可溶于KI形成
可溶于KI形成![]() ,向两支盛有
,向两支盛有![]() 溶液的试管中,分别滴加淀粉溶液和
溶液的试管中,分别滴加淀粉溶液和![]() 溶液,前者溶液变蓝,后者有黄色沉淀,说明
溶液,前者溶液变蓝,后者有黄色沉淀,说明![]() 溶液中存在平衡:
溶液中存在平衡:![]()
B.物质的量浓度相等的![]() 和
和![]() 溶液等体积混合后的溶液:
溶液等体积混合后的溶液:![]()
C.已知:![]() ,
,![]() ,将等体积的浓度为
,将等体积的浓度为![]() 的
的![]() 溶液滴入到浓度均为
溶液滴入到浓度均为![]() 的KCl和
的KCl和![]() 的混合溶液中产生两种不同沉淀,且
的混合溶液中产生两种不同沉淀,且![]() 沉淀先产生
沉淀先产生
D.![]() 时,溶液中水电离出的
时,溶液中水电离出的![]() 和水电离出的
和水电离出的![]() 的乘积一定等于
的乘积一定等于![]()
科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. 电离常数:Ka(HB)>Ka(HA)
B. Ka(HA)的数量级为10-5
C. 当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D. 等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
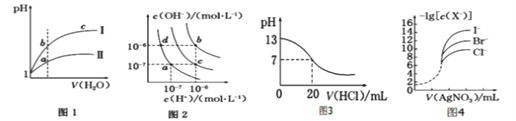
A. 图1表示同温度下,pH=1 的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线Ⅱ为醋酸,且a 点溶液的导电性比b 点强
B. 图2 中纯水仅升高温度,不能使a点变到c点
C. 图3 表示25 ℃时,用0.100 0 molL-1HCl 滴定20 mL 0.100 0 molL-1NaOH 溶液,溶液的pH随加入盐酸体积的变化
D. 用0.010 0 molL-1AgNO3标准溶液滴定浓度均为0.100 0 molL-1Cl-、Br-及I-的混合溶液,由图4 曲线,可确定首先沉淀的是I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
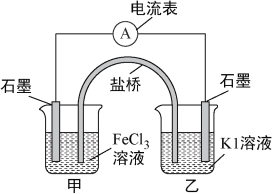
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol/L的氨水滴入10mL0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A.a点KW=1.0×10-14
B.水的电离程度:b>c>a>d
C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,一水合氨的电离平衡常数为10-7/(10n-1)(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期元素的第一电离能随原子序数的增大,总趋势逐渐增大。镓![]() 的基态电子排布式是_____,
的基态电子排布式是_____,![]() 的第一电离能明显低于
的第一电离能明显低于![]() ,原因是______。
,原因是______。
(2)多酚氧化酶与植物的抗病性有关。配合物![]() 是多酚氧化酶的模型配合物。
是多酚氧化酶的模型配合物。
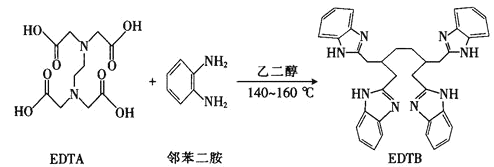
![]() 一个EDTA分子中
一个EDTA分子中![]() 键的数目为______________。
键的数目为______________。
![]() 分子中所含元素的电负性由小到大的顺序为______________________。
分子中所含元素的电负性由小到大的顺序为______________________。
![]() 与
与![]() 互为等电子体的一种阴离子为___________________。
互为等电子体的一种阴离子为___________________。
![]() 配离子
配离子![]() 中的配位原子是__________________。
中的配位原子是__________________。
(3)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,再向该溶液中加入乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是____________________________________________![]() 用相关的离子方程式和简单的文字说明加以解释
用相关的离子方程式和简单的文字说明加以解释![]() 。
。
(4)![]() 溶解在NaOH溶液中,可得到钒酸钠
溶解在NaOH溶液中,可得到钒酸钠![]() ,该盐阴离子中V的杂化轨道类型为______________;也可以得到偏钒酸钠,其阴离子呈如图1所示的无限链状结构,则偏钒酸钠的化学式为_________________________。
,该盐阴离子中V的杂化轨道类型为______________;也可以得到偏钒酸钠,其阴离子呈如图1所示的无限链状结构,则偏钒酸钠的化学式为_________________________。

(5)钒的某种氧化物晶胞结构如图2所示。该氧化物的化学式为_____________,若它的晶胞参数为![]() ,则晶胞的密度为__________
,则晶胞的密度为__________![]() 写计算式
写计算式![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com