
����Ŀ����20mLij���ʵ���Ũ�ȵ�AlCl3��Һ����εμ�2mol/L NaOH��Һֱ�����������ⶨ�������NaOH��Һ�����(mL)�����ó��������ʵ���(mol)�Ĺ�ϵ����ͼ��ʾ����
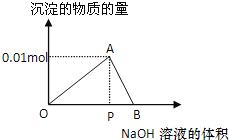
(1)д���������߶η�����Ӧ�����ӷ���ʽ��OA��____________��AB��___________��ͼ���߶�OP��PB��___________��
(2)����ԭAlCl3��Һ�����ʵ���Ũ��Ϊ_________��
(3)ͼ��A��Ӧ�ĺ�����Ϊ______mL��
(4)������12mL NaOH��Һʱ������������Ϊ______mol��
(5)�������NaOH��Һ����ʱ��ʹ������ɵij��������ܽ⣬Ҫ�õ��루4������ͬ�ij�����������NaOH��Һ�����Ϊ_________��
���𰸡�Al3++3OH����Al(OH)3�� Al(OH)3+OH����AlO2��+2H2O 3��1 0.5mol/L 15 0.008 16mL
��������
��20mLij���ʵ���Ũ�ȵ�AlCl3��Һ�еμ�2mol/LNaOH��Һʱ����μ���NaOH��Һֱ�������������з����ķ�ӦΪ��Al3++3OH-��Al(OH)3������Al(OH)3+OH-��AlO2��+2H2O��ͼ����OA��Ϊ������Ӧ�٣�AB��Ϊ���������ܽⷢ����Ӧ�ڣ����ݸ�����Ӧ�����жϣ������йؼ��㡣
��1�����ݷ�����֪OA�η����ķ�Ӧ���Ȼ������������Ʒ�Ӧ������������������������Ĺ��̣���Ӧ���ӷ���ʽΪAl3++3OH-��Al(OH)3����AB�η����������������ܽ�������������Һ��������ȫ���ܽ⣬��Ӧ�����ӷ���ʽΪAl(OH)3+OH-��AlO2��+2H2O�����ݷ�Ӧ��֪�õ���������������ͳ���ȫ���ܽ������������������ʵ���Ϊ3��1������������ҺŨ��һ����������Һ�����Ϊ3��1����ͼ���߶�OP��PB��3��1��
��2��ͼ���з����õ���������������������ʵ���Ϊ0.01mol�������Ȼ������ʵ���Ϊ0.01mol����ҺŨ��Ϊ0.01mol��0.02L=0.5mol/L��
��3��ͼ���з����õ���������������������ʵ���Ϊ0.01mol���������������������ʵ���Ϊ0.03mol������������Һ�����Ϊ0.03mol��2mol/L=0.015L=15mL��
��4��������12mLNaOH��Һʱ�Ȼ����������������������ݷ�ӦAl3++3OH-��Al(OH)3���ɼ���õ���0.012L��2mol��L��1��3=0.008mol��
��5���������NaOH��Һ����ʱ��ʹ������ɵij��������ܽ⣬Ҫ�õ��루4������ͬ�ij�������������ӦAl3++3OH-��Al(OH)3����Al(OH)3+OH-��AlO2��+2H2O�����������Ϊ0.01mol�����������������ʵ���Ϊ0.03mol�������ܽ�����ʵ���Ϊ0.01mol-0.008mol=0.002mol��������������0.002mol�����Թ������������Ƶ����ʵ���Ϊ0.002mol+0.03mol=0.032mol����Ҫ����������Һ���Ϊ0.032mol��2mol/L=0.016L=16mL��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ijУ��ȤС���ͬѧ���С��ȽϹ��������ڲ�ͬ�����µķֽ⡱��ʵ�飬���Ƕ�ʵ��Ĵ������±���ʾ��
�Թ� ��� | ʵ�鴦�� | ||
�����������Ϊ3%��H2O2��Һ��mL�� | �¶� | �����Լ� | |
�Թ�1 | 2 | ���� | 2������ˮ |
�Թ�2 | a | 90�� | 2������ˮ |
�Թ�3 | 2 | ���� | 2����������Ϊ3.5%��FeCl3��Һ |
�Թ�4 | 2 | b | 2����������Ϊ20%�ĸ�����ĥҺ |
��1�������е�a��bӦ��д�����ݷֱ��� �� �����ϱ���ʵ�鴦���У��о�����Щ�Ա���? ��
��2�����е��������Թܶ��գ����о������������������Ч�ʵIJ�� ��
��3����̽���¶ȶ�ø���Ե�Ӱ��ʱ�� �����������������������ù�������Ϊʵ�������
����ijУ��ȤС����ͬѧ��������̽����ĸ��ϸ����������ʽ����ʵ�顣������������
���ṩ�����ף�ÿ����������ʵ��װ����ͼ����a��d����ʾ��

��1����Ҫ̽���ľ��������ǣ���ĸ���Ƿ������������������¾��ܲ���CO2������ʵ��Ŀ��ѡ��װ����ţ����������µ�װ�����Ϊc��b��a��b�������������µ�װ�����Ϊ�� ������ĸ�ͼ�ͷ��ʾ����
��2��װ����cƿ�������ǣ� ��bƿ�г����ʯ��ˮ������������ݷ���ˮ��Һ����������ɫ�仯Ϊ�� ��
��3������ͼ����ʾװ�ã���Ƥ���ϵ����Ϊ���к�ɫҺ�εĿ̶Ȳ����ܣ���̽����ĸ����ϸ���������͡���õ�ʵ����ۻ�����ͬʱ���ö���ʵ��������ʵ��װ�ã������װ�ñ��Ϊ�������õ�����ˮ����NaOH��Һ�⣬���������װ������ͬ��
��Ԥ�����������ϵ�������д�±���
��� | װ���к�ɫҺ�ε��ƶ����� | ���� | |
װ���� | װ���� | ||
1 | ������ | ���ƶ� | ֻ������������ |
2 | ���ƶ� | ������ |
|
3 | ������ |
| �Ƚ��������������ֽ����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ͬ���칹����Ŀ�������У���ȷ����
A. C2H6Oֻ��һ�ֽṹ
B. ����ʽ����C5H11Cl �Ļ�������6��
C. ��֪���ȱ���3��ͬ���칹�壬�����ȱ���ͬ���칹�����ĿΪ3��
D. �ƵĽṹ��ʽΪ![]() ���������ᷴӦ��������10��һ����ȡ����
���������ᷴӦ��������10��һ����ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ԫ���� H2Y ��Һ�еμ� KOH ��Һ�����û����Һ�� pH ������Ũ�ȱ仯�Ĺ�ϵ����ͼ��ʾ�������й�˵����������

A. ���� M ��ʾ pH�� lg![]() �ı仯��ϵ
�ı仯��ϵ
B. a����Һ�У�c(H+) �D c(OH-)��2c(Y2��)��c(HY-) �D c(K+)
C. H2Y �ĵڶ������볣��Ka2(H2Y)��10��4.3
D. ����b����Һ�У�c(H2Y)��c(Y2-)��c(HY-)��c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ����β���е�NO���������¼��ַ�����
��1���������������ϰ�װ��ת������NO��CO�����Ϊ����β���ijɷ֣������������ڴ�ת�����з�����Ӧ��2CO(g)��2NO(g)![]() N2(g)��2CO2(g) ��H ��
N2(g)��2CO2(g) ��H ��
����֪��N2(g)+O2(g)=2NO(g)��H1����180.5kJ��mol��1
C(s)+O2(g)=CO2(g) ��H2����393.5kJ��mol��1
2C(s)+O2(g)=2CO(g)��H3����221kJ��mol��1
���H=______��
��һ����ȤС���ij����������ʱ��β��������������CO��NO�ٷֺ�����ʱ��仯��ͼ1��ʾ��ǰ0��10s �Σ�CO��NO�ٷֺ���û���Ա仯��ԭ����_____________________��ͬʱ��С���ڹ̶��ݻ�Ϊ2L���ܱ�������ͨ��NO��CO��2mol���з�Ӧ��n(CO2)���¶ȣ�T����ѹǿ��P����ʱ�䣨t���ı仯������ͼ2��ʾ��ͼ�е����ߢ��Ӧ��Ӧ�ӿ�ʼ��ƽ��ʱ��CO2��ʾ��ƽ����Ӧ���ʷֱ�Ϊv(��)��v����v���������ߴ�С��ϵΪ______________��

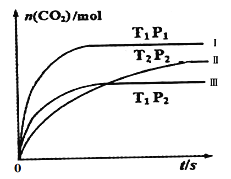
ͼ1 ͼ2
��2������̿Ҳ�����ڴ�������β���е�NO����1L�����ܱ������м���0.1000molNO��2.030mol�������̿������A��B�������壬�ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ����Լ�������ѹǿ���±���
����̿/mol | NO/mol | A/mol | B/mol | P/MPa | |
200�� | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
X | 2.005 | 0.0500 | 0.0250 | 0.250 | 4.56 |
�����ϱ����ݣ�д�������з�����Ӧ�Ļ�ѧ����ʽ____�����ж�X_____200�棨�á���������������=����գ������㷴Ӧ��ϵ��200��ʱ��ƽ�ⳣ��Kp =_____����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�������������
��3���ü�ӵ绯ѧ����ȥNO�Ĺ��̣���ͼ��ʾ����֪���ص�����������Һ��pH��4~7֮�䣬B��Ϊ_________(���������������)��д��A���ĵ缫��Ӧʽ��____________��
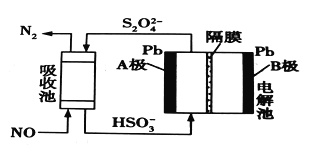
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���

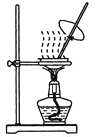
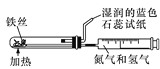
�� �� �� ��
A. ��װ�ü����к��ȵIJⶨ
B. ��װ������ȡCO2����
C. ��װ�ñ�����CH3COONa��Һ��CH3COONa����
D. ��װ�ö�ģ�ҵ�ư������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X��ij��ҩ�����Ҫ�ɷ֣���ҵ�Ϻϳɸû������һ��·������(���ַ�Ӧ���Ӧ������ȥ)��

��֪�����뺬�ǻ��Ļ�����ɷ���������������Ӧ��RCOO R�䣫R��OH![]() RCOOR�士R��OH(R��R�䡢R�����������)��
RCOOR�士R��OH(R��R�䡢R�����������)��
��1����Ӧ��������Լ���_______����Ӧ�ڵķ�Ӧ������_________��
��2��B�к��������ŵ�������________����Ӧ�ܵIJ������X���⣬��һ�ֲ����������________��
��3��D��һ���������ܷ������۷�Ӧ���ɸ߷��ӻ�����ø߷��ӻ�����Ľṹ��ʽΪ____________��
��4����Ӧ�۵Ļ�ѧ����ʽΪ_______________________��
��5��E��ͬ���칹���ж��֣�д�����������������л���ṹ��ʽ________��
��.������һ�ȴ���ֻ��һ��
��.���Ȼ�����Һ������ɫ��Ӧ
��.����̼��������Һ��Ӧ�ų�CO2
��6����֪����![]()
![]()
![]() ���ڵ�����������һ������CH3����Cl��ʱ���������ȡ����һ����������λ���λ��������������һ������NO2����COOH��ʱ���������ȡ����һ�������ļ�λ����д���Լױ����Ҵ�Ϊԭ���Ʊ�
���ڵ�����������һ������CH3����Cl��ʱ���������ȡ����һ����������λ���λ��������������һ������NO2����COOH��ʱ���������ȡ����һ�������ļ�λ����д���Լױ����Ҵ�Ϊԭ���Ʊ� �ĺϳ�·��ͼ(���Լ�����)____________��
�ĺϳ�·��ͼ(���Լ�����)____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ��������������ȷ���ǣ� ��
A. 1 mol NH3�����е�ԭ����ΪNA
B. ��100 mL 0.1 mol��L-1��FeCl3��Һ�����ˮ�п��Ƶ�Fe(OH)3��������ĿΪ0.01NA
C. ���³�ѹ�£�48gO2��O3�Ļ������������ԭ����Ϊ3NA
D. 1L 0.1 mol��L-1 NaCl��Һ��������Na+ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Һ��ֻ��Na+��CH3COO����H+��OH���������ӣ�������������ȷ����
A. ����Һ����pH=3��CH3COOH��pH=11��NaOH��Һ�������϶���
B. ����Һ���ɵ����ʵ���Ũ�ȡ��������NaOH��Һ��CH3COOH��Һ��϶���
C. ��������NaOH����Һ������Ũ��Ϊc(CH3COO������c(Na+ ����c(OH������c(H+��
D. ����������ˮ��c(CH3COO����һ������c(Na+����c(NH4+��֮��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com