
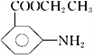
【题目】有机物X是某种药物的主要成分,工业上合成该化合物的一种路线如下(部分反应物、反应条件略去):

已知:酯与含羟基的化合物可发生如下酯交换反应:RCOO R′+R″OH![]() RCOOR″+R′OH(R、R′、R″均代表烃基)。
RCOOR″+R′OH(R、R′、R″均代表烃基)。
(1)反应①所需的试剂是_______,反应②的反应类型是_________。
(2)B中含氧官能团的名称是________;反应④的产物除了X以外,另一种产物的名称是________。
(3)D在一定条件下能发生缩聚反应生成高分子化合物,该高分子化合物的结构简式为____________。
(4)反应③的化学方程式为_______________________。
(5)E的同分异构体有多种,写出符合下列条件的有机物结构简式________。
Ⅰ.苯环上一氯代物只有一种
Ⅱ.与氯化铁溶液发生显色反应
Ⅲ.能与碳酸氢钠溶液反应放出CO2
(6)已知:①![]()
![]()
![]() ;②当苯环上已有一个“—CH3”或“—Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“—NO2”或“—COOH”时,新引入的取代基一般在它的间位。请写出以甲苯、乙醇为原料制备
;②当苯环上已有一个“—CH3”或“—Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“—NO2”或“—COOH”时,新引入的取代基一般在它的间位。请写出以甲苯、乙醇为原料制备 的合成路线图(无机试剂任用)____________。
的合成路线图(无机试剂任用)____________。
【答案】 浓硝酸、浓硫酸 还原反应 硝基 甲醇 ![]()
![]() +CH3OH
+CH3OH![]()
![]() +H2O
+H2O 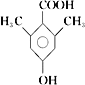 或
或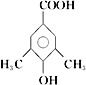
![]()
![]()
![]()
![]()
![]()
![]()
【解析】分析:根据A与B的结构简式可知反应①是硝化反应,反应②中硝基转化为氨基,反应②是还原反应,根据D与E的结构简式可知反应③是酯化反应,根据已知信息可知反应④是酯交换反应,X的结构简式为![]() ,据此解答。
,据此解答。
详解:(1)反应①是苯环上的氢原子被硝基取代,因此所需的试剂是浓硝酸、浓硫酸;反应②中硝基转化为氨基,反应②是还原反应。
(2)根据B的结构简式可知B中含氧官能团的名称是硝基;根据已知信息结合原子守恒可知反应④的产物除了X以外,另一种产物的结构简式为CH3OH,其名称是甲醇。
(3)D分子中含有羧基和羟基,在一定条件下能发生缩聚反应生成高分子化合物,该高分子化合物的结构简式为![]() 。
。
(4)反应③是酯化反应,反应的化学方程式为![]() +CH3OH
+CH3OH![]()
![]() +H2O。
+H2O。
(5)E的同分异构体有多种,苯环上一氯代物只有一种,说明苯环上的氢原子只有一类。与氯化铁溶液发生显色反应,说明含有酚羟基;能与碳酸氢钠溶液反应放出CO2,说明含有羧基,要使苯环上的氢原子只有一类,则苯环上还含有2个甲基,结构对称,则符合条件的有机物结构简式为 或
或 ;
;
(6)根据已知信息结合逆推法可知以甲苯、乙醇为原料制备 的合成路线图(无机试剂任用)为
的合成路线图(无机试剂任用)为![]()
![]()
![]()
![]()

![]()

![]()
 。
。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)有以下四种物质①22g二氧化碳;②5g氢气;③1.204×1024个氮气分子;④4℃时18g水,质量最大的是_______;常温时体积最大的是________(填序号)。
(2)标准状况下,336L的NH3溶于1L水中,若该溶液的密度为ag/cm3,则其物质的量浓度为____________。
(3)若20g密度为ρg·cm-3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是_______________。
(4)现有下列九种物质:①AgCl ② 铜 ③液态醋酸 ④CO2 ⑤纯硫酸 ⑥Ba(OH)2固体 ⑦C2H5OH ⑧稀硝酸 ⑨熔融NaOH。
①上述属于电解质的是_______________________。
②上述九种物质中有两种物质之间可发生离子反应H++OH-=H2O,该离子反应对应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期主族元素。它们满足以下条件:①在元素周期表中,Y、Z、W的位置如图所示,且Y、Z、W三种元素的原子最外层电子数之和为17;②X、Y、W分别位于不同周期。下列说法正确的是

A. 四种元素的原子半径大小顺序为W>Y>X>Z
B. Z、W元素的最简单氢化物的沸点为H2Z<H2W
C. X、Y、Z既能形成离子化合物,又能形成共价化合物
D. X分别与Y、Z之间形成的核外电子总数为10的微粒只有YX3和X2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中逐滴滴加2mol/L NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如下图所示。则:
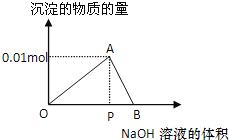
(1)写出代表各线段发生反应的离子方程式:OA段____________,AB段___________,图中线段OP∶PB=___________。
(2)计算原AlCl3溶液的物质的量浓度为_________。
(3)图中A对应的横坐标为______mL。
(4)当加入12mL NaOH溶液时,产生沉淀量为______mol。
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示。下列有关溶液中粒子浓度关系的描述中,错误的是( )
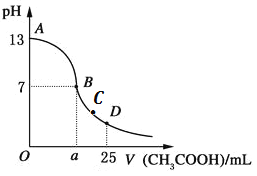
A. 在A、B间可能存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 在B点:a =12.5,且有c(Na+)=c(CH3COO-)
C. 在C点:c(CH3COO-) > c(Na+) >c(H+)>c(OH-)
D. 在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:

(1)汽车发动机工作时会引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。
2NO(g),是导致汽车尾气中含有NO的原因之一。一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。
①反应2NO(g) ![]() N2(g)+O2(g)为________反应(填“吸热”或“放热”);
N2(g)+O2(g)为________反应(填“吸热”或“放热”);
②一定温度下,能够说明反应2NO(g) ![]() N2(g)+O2(g)已达到平衡的是______(填序号);
N2(g)+O2(g)已达到平衡的是______(填序号);
a.容器内的压强不发生变化 b.混合气体的密度不发生变化
c.NO、N2、O2的浓度保持不变 d.单位时间内分解4 mol NO,同时生成2 mol N2
(2)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=== 4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mo1-1
写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:______________________;
(3)大气污染物氮氧化物可以用活性炭还原法处理。某研究小组向某0.5L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间测得各物质的物质的量如下:
N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间测得各物质的物质的量如下:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.32 | 0.32 |
N2 | 0 | 0.21 | 0.30 | 0.30/span> | 0.34 | 0.34 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.17 | 0.17 |
①0~10min内,NO的平均反应速率v(NO)=________________;T1℃时,该反应的平衡常数K=___________________________;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是__________(填字母编号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
f.移出一定量的CO2
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 H_________0(填“>”或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiC14是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):
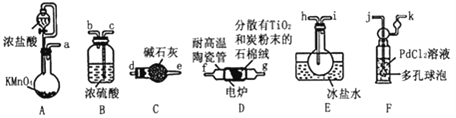
已知:
①PdC12溶液捕获CO时,生成金属单质和两种酸性气体化合物。
②TiC14的制备需无水无氧且加热。
③
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 水溶性 |
TiCl4 | -25 | 136.4 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水,与TiCl4互溶 |
请回答下列问题:
(1)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为__________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为a→____→____→f→g→___→____→_____→_____→_____(填仪器接口字母)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;_____________(按正确的顺序填入下列操作的序号)。
①加热装置D中陶瓷管 ②打开分液漏斗活塞
③停止加热,充分冷却 ④关闭分液漏斗活塞
实验时,当观察到____________________________时,开始进行步骤①。
(4)设计实验证明装置E中收集到的液体中含有TiCl4:___________。
(5)装置F中发生反应的化学方程式为____________________。
(6)制得的TiC14产品中常含有少量CC14,从产品中分离出TiC14的操作名称为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na 与CO2反应产物,某化学兴趣小组按下图装置进行实验。
已知:CO + 2Ag ( NH3) 2OH=2Ag↓+( NH4 ) 2CO3 +2NH3

回答下列问题:
(1)写出A 中反应的离子方程式__________________________。
(2)仪器X 的名称是_____________,B 中的溶液为________________。
(3)先称量硬质玻璃管的质量为m1 g ,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g 。再进行下列实验操作,其正确顺序是________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E 中出现浑浊
e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g 。
(4)加热硬质玻璃管一段时间,观察到以下现象
① 钠块表面变黑,熔融成金属小球;
② 继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③ F 中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________。
(5)探究固体产物中元素Na 的存在形式
假设一:只有Na2CO3;假设二:只有Na2O ;假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤 | 假设一成立 |
2 | 往步骤1所得滤液中___________________________ | |
3 | _____________________________________________ |
(6)根据上述实验现象及下表实验数据,写出Na 与CO2反应的总化学方程式___________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com