
����Ŀ����ˮ�������һ�����õ�ˮ�뺣ˮ֮�京���������з���ĵ�أ����ܷ�ӦΪ��5MnO2��2Ag��2NaCl=Na2Mn5O10��2AgCl����ͼ����ˮ�����Ϊ��Դ�������FeCl2��Һ��X�缫������Һ�ȱ�ƣ������йط�������ȷ����(����)

A.��װ��ֻ�漰��������֮���ת��
B.����·�а�װ��ѹ����װ�ã���ͨ�������ж�Fe2+��Cl-�Ļ�ԭ��ǿ��
C.��ˮ�������Na+�����������ƶ�
D.��Ϊ��������缫��ӦʽΪAg��Cl--e-=AgCl
���𰸡�A
��������
���ݡ� ˮ������ܷ�Ӧ��֪��Ag�ڸ�������������Ӧ��MnO2������������ԭ��Ӧ����X�缫������Һ�ȱ�ƣ���֪X�缫��Fe2+ʧ���ӣ�������ΪFe3+����X�缫Ϊ������Y�缫Ϊ������������������I����ֱ�Ϊ��ˮ����ص�����������
A����ˮ����ع���ʱ��ѧ��ת��Ϊ���ܣ�ͬʱ�����������ı仯����A����
B������X�缫������Һ�ȱ�ƿ�֪������Fe2+������������Cl-��������������·�а�װ��ѹ����װ�ã���ɸ��ݵ�ѹ�������ж�Fe2+��Cl-�Ļ�ԭ��ǿ���� ��B��ȷ��
C����ˮ����ع���ʱΪԭ��أ�ԭ������������������ƶ������������ƶ�������ˮ�������Na+�����������ƶ�����C��ȷ��
D�����������������֪IIΪ��ˮ����صĸ�����������Agʧ���ӷ���������Ӧ����缫��ӦʽΪAg+Cl--e-=AgCl����D��ȷ��
��ѡA��


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д� ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�շ��Dzⶨ�л������ʽ��һ����Ҫ��������ȫȼ�� 0.1mol ij��������ɵĶ�����̼Ϊ 11.2 L(��״��)�����ɵ�ˮΪ 10.8g��������������գ�
(1)�����ķ���ʽΪ_________��
(2)д�������ܴ��ڵ�ȫ�����ʵĵĽṹ��ʽ ��_________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)��5L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol����˷�Ӧ��ƽ������
4NO(g) + 6H2O(g)��5L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol����˷�Ӧ��ƽ������![]() x
x
A. ![]() (O2) = 0.01mol��(L��s) �C1 B.
(O2) = 0.01mol��(L��s) �C1 B. ![]() (NO) = 0.008mol��(L��s) �C1
(NO) = 0.008mol��(L��s) �C1
C. ![]() (H2O) = 0.006mol��(L��s) �C1 D.
(H2O) = 0.006mol��(L��s) �C1 D. ![]() (NH3) = 0.002mol��(L��s) �C1
(NH3) = 0.002mol��(L��s) �C1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ���L��������Ĺ�ѧ���ʣ������ڹ����ϣ���ϳ�·�����£�
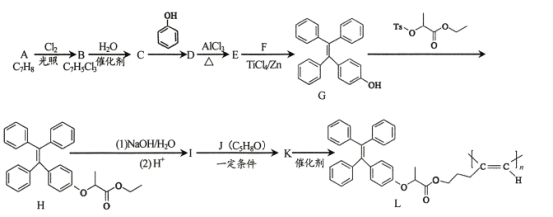
��֪��
i���л�����ü���ʽ��ʾ����![]() �ɱ�ʾΪ
�ɱ�ʾΪ
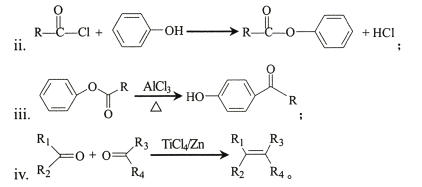
(1) A��B�Ļ�ѧ����ʽΪ____��
(2)D�Ľṹ��ʽΪ____��
(3)E�к��еĺ���������Ϊ____ ��
(4) G��H�ķ�Ӧ����Ϊ____��
(5)I��K�Ļ�ѧ����ʽΪ____��
(6)����˵����ȷ����______����ĸ��ţ���
a��A����������̼ԭ�Ӿ���ͬһƽ�� b��C�Ľṹ��ʽΪ![]()
c��F+F��G�ĸ���������2�ֻ�Ϊ˳���칹�� d��1 mol H�������2 molNaOH��Ӧ
(7)��������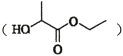 �Ǻϳ�
�Ǻϳ�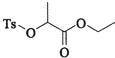 ���м��塣��ͼ��ijͬѧ��Ƶĺϳ��������������̡�
���м��塣��ͼ��ijͬѧ��Ƶĺϳ��������������̡�
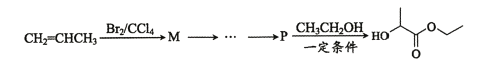
��д��M-P�ĺϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S��SO2��Ի��������彡�����������Σ������ҵ�ϲ�ȡ���ַ���������Щ�к�������ŷţ��ش����и������е����⡣
��H2S�ij�ȥ
����1��������H2S��ԭ��Ϊ��
H2S+Fe2(SO4)3![]() S��+2FeSO4+H2SO4
S��+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
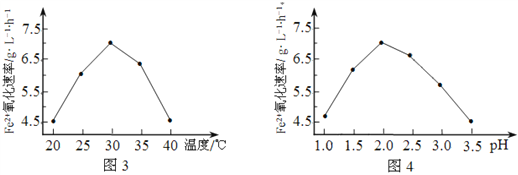
��1����˾�����ʱ��FeSO4����������������ʱ��5��105�����þ���������______________��
��2����ͼ3��ͼ4�ж�ʹ����˾����������Ϊ______________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����______________��
����2����һ�������£���H2O2����H2S
��3�����Ųμӷ�Ӧ��n(H2O2)/n(H2S)�仯���������ﲻͬ����n(H2O2)/n(H2S)=4ʱ����������ķ���ʽΪ__________��
��SO2�ij�ȥ
����1��˫�������NaOH����SO2������CaOʹNaOH����
NaOH��Һ![]() Na2SO3
Na2SO3
��4��д�����̢ٵ����ӷ���ʽ��____________________________��CaO��ˮ�д�������ת����
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
��ƽ���ƶ��ĽǶȣ��������̢�NaOH������ԭ��____________________________________��
����2���ð�ˮ��ȥSO2
��5����֪25�棬NH3��H2O��Kb=1.8��105��H2SO3��Ka1=1.3��102��Ka2=6.2��108������ˮ��Ũ��Ϊ2.0 mol��L-1����Һ�е�c(OH)=_________________mol��L1����SO2ͨ��ð�ˮ�У���c(OH)����1.0��107 mol��L1ʱ����Һ�е�c(![]() )/c(
)/c(![]() )=___________________��
)=___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ��������˵��������ǣ�������

A. A��B��D�������Ƽ��仯���� B. A��B��D������þ���仯����
C. A��B��D�����������仯���� D. A��B��D�����Ƿǽ������仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���5.6 g����Ͷ��100 mL 2 mol��L-1ϡ�����У�2 minʱ����ǡ����ȫ�ܽ⡣���ڸ÷�Ӧ�����ʣ���λͬѧ��������ֱ�ʾ������
�ף�v(Fe)��2.8 g��min-1���ң�v(H2SO4)��1 mol��L-1��min-1������v(FeSO4)��0.5 mol��L-1��min-1�� ����v(H2)��1.12 L��min-1��
����˵����ȷ����(����)
A.�״�����Ϊ�������ʲ���������ʾ��Ӧ����
B.��������Ϊ���ʵĵ�λ����
C.ֻ���Ҵ���
D.ֻ�б���ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪʯī�缫��E��F�ֱ�Ϊ���������ڵ����ֻ��ý����е�һ�֣���E����NaOH��Һ��Ӧ����ͼ��ͨ��·����Ӧһ��ʱ�䣬����·��ͨ��1.0��10-3mol����ʱ������������ȷ���ǣ� ��
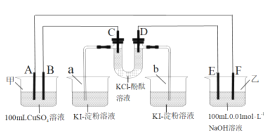
A.U���е�D���ȱ�죬b�ձ��е���Һ�����
B.a�ձ��������0.127gI2��KI���������ɣ��׳��е����������0.04g��CuSO4��Һ������
C.A��������������Ϊ5.6mL���׳���Һ��pHֵΪ2
D.E�缫��������Һ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������������̽��NH3�����ʡ�ʵ��ʱ��NaOH�����ϵμ���Ũ��ˮ����������һ������������档�±��ж�ʵ�����������Ľ�����ȷ����(����)

ѡ�� | ʵ������ | ���� |
A | Ũ���ḽ���������� | NH3��Ũ���ᷴӦ������NH4Cl���� |
B | Ũ���ḽ������������ | NH3��Ũ���������Ӧ |
C | �Ȼ�����Һ����� | ����Һһ����AlCl3��Һ |
D | �����ʯ����ֽ����ɫ��ʪ���ʯ����ֽ���� | NH3��һ�ֿ����Լ� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com