
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。![]() 固定装置已略去
固定装置已略去![]()
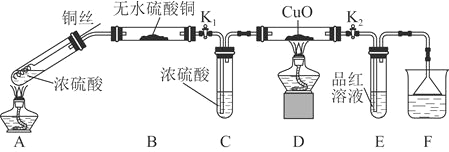
(1)A中反应的化学方程式为____________。
(2)F烧杯中的溶液通常是________________。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是______。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为_______。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
硫酸(mol/L) | 黑色物质出现的温度(℃) | 黑色物质消失的温度(℃) |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是_________。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用bmol/LNa2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为________。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
【答案】(1)Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)NaOH溶液(或酸性KMnO4溶液等)
(3)D装置中黑色固体颜色无变化,E中溶液褪色
(4)将A装置中试管内冷却的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,看溶液是否变蓝
(5)使用上述装置,不放入铜丝进行实验,观察无水硫酸铜是否变蓝
(6)abd (7)![]() %
%
【解析】
(1)反应的还原产物为SO2;(2)该实验尾气为SO2,可以用强碱或者强氧化剂溶液吸收;(3)要证明浓硫酸中硫元素的氧化性强于氢元素则需证明A中还原产物为SO2而非H2,产物为SO2则D中黑色固体颜色不变,E中品红溶液会褪色;(4)若含有Cu2+则溶于水显蓝色;(5)对比实验中,不加入铜丝则反应不会发生,由现象可以判断反应外的因素对实验是否存在影响;(6)生成物可能不止一种,则反应可能不止一个,a项正确;硫酸浓度越低,黑色物质出现的温度越高,消失的温度越低,则硫酸浓度选择适当,可避免最后产物中出现黑色物质,b项正确;只要控制在合适的温度,浓硫酸浓度小于15 mol/L也可与铜反应,c项错误;硫酸浓度越大,黑色物质出现温度越低,消失温度越高,d项正确;(7)滴定反应溶液中铜离子的物质的量为![]() mol,滴定I2消耗的Na2S2O3的物质的量为
mol,滴定I2消耗的Na2S2O3的物质的量为![]() mol,可知反应生成的I2的物质的量为
mol,可知反应生成的I2的物质的量为![]() mol,反应生成的Cu2+的物质的量为
mol,反应生成的Cu2+的物质的量为![]() mol,则CuSO4的产率为
mol,则CuSO4的产率为![]() %。
%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子物质,据图分析不正确的是( )

A. 若物质A是动、植物细胞中均含有的储能物质,则A是脂肪
B. 物质b是氨基酸,若某种B分子由n个b分子(平均相对分子质量为m)组成的2条链组成,则该B分子的相对分子质量大约为mn﹣18(n﹣2)
C. 物质c在人体细胞中共有5种,分子中的含氮碱基不同决定了c的种类不同
D. 物质d是性激素,d和胆固醇、维生素D都属于固醇类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行下列实验,其中丙中实验现象描述正确的是

实验 | 试剂甲 | 试剂乙 | 试剂丙 | 丙中的现象 |
A | 浓硫酸 | 亚硫酸钠 | 紫色石蕊试液 | 溶液先变红后褪色 |
B | 浓盐酸 | 高锰酸钾 | 淀粉碘化钾溶液 | 溶液会变蓝 |
C | 稀盐酸 | 碳酸钙 | 氯化钡溶液 | 有白色沉淀生成 |
D | 浓氨水 | 氧化钙 | 氯化铝溶液 | 先生成白色沉淀然后沉淀溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当航天飞机返回地球大气层时,由于与空气的剧烈摩擦,飞机尖端的温度可达1000℃以上,为了防止高温将其烧毁,科学家给航天飞机的相应部位安装了可靠的保护层。制作保护层的材料是
A.塑料B.玻璃
C.新型陶瓷D.镁铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液 ④CH3COONH4溶液各25mL,物质的量浓度均为0.l mol/L,下列说法正确的是( )
A. 四种溶液的pH大小顺序是③>②>①>④
B. 若分别加入25 mL 0.1 mol/L的盐酸充分反应后,pH最大的是①
C. 若将四种溶液稀释相同倍数,pH变化最大的是④
D. 升高温度,③溶液的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:

(1)化合物Li2Ti5O15中钛元素的化合价是+4价,氧元素的化合价为__________。
(2)钛铁矿与硫酸反应时,常将钛铁矿粉碎,其目的是:__________,滤渣A的成分是__________。
(3)固体TiO2转化(NH4)2Ti5O15的离子方程式为__________,该反应__________氧化还原反应 (填“属于” 或“不属于” )。
(4)反应②中固体TiO2、转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降的原因是__________。

(5)(NH4)2Ti5O15转化为Li2Ti5O15的离子方程式为:__________。
(6)写出由滤液D生成FePO4的离子方程式__________。
(7)由滤液D制各LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl+ClO
2H+ + Cl+ClO
B. AlCl3溶液中加入过量的浓氨水:Al3+ + 3NH3H2O = Al(OH)3 ↓ + 3NH4+
C. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
D. 向FeCl3溶液中加入铁粉:Fe3+ + Fe = 2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液态烃,0.1 mol该烃在足量的氧气中完全燃烧,生成0.6 mol CO2和0.3 molH2O;回答下列问题:
(1)A的电子式________,B的结构简式________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_______,反应类型:______________。
(3)在碘水中加入B物质的现象:________________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:__________,反应类型:______________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量__(填“A>B”、“A<B”或“A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则溶液中![]() _________(填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式:__________________________________________。
_________(填“增大”“不变”或“减小”);写出该混合溶液中所有离子浓度之间存在的一个等式:__________________________________________。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:________________。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为______________________。
(3)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入40 mL 0.1 mol·L-1 HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:

①在同一溶液中,H2CO3、HCO3-、CO32-____(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为____________,溶液中各种离子的物质的量浓度的大小关系为____________。
③已知在25 ℃时,CO32-水解反应的平衡常数即水解常数Kh=![]() =2.0×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____。
=2.0×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com