
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:

(1)化合物Li2Ti5O15中钛元素的化合价是+4价,氧元素的化合价为__________。
(2)钛铁矿与硫酸反应时,常将钛铁矿粉碎,其目的是:__________,滤渣A的成分是__________。
(3)固体TiO2转化(NH4)2Ti5O15的离子方程式为__________,该反应__________氧化还原反应 (填“属于” 或“不属于” )。
(4)反应②中固体TiO2、转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降的原因是__________。

(5)(NH4)2Ti5O15转化为Li2Ti5O15的离子方程式为:__________。
(6)写出由滤液D生成FePO4的离子方程式__________。
(7)由滤液D制各LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是__________。
【答案】 -2、-1 增大接触面积加快反应速率,提高浸出率 SiO2 CaSO4 5TiO2+4H2O2+2NH3·H2O=2NH4++Ti5O152-+5H2O 不属于 温度过高时,反应物氨水(或双氧水)会受热分解 Ti5O152-+2Li+=Li2Ti5O15↓ 2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+ 20∶9
【解析】铁矿石加入硫酸溶解过滤得到滤渣A为二氧化硅和硫酸钙,滤液B中含有Mg2+、Fe2+、Ti4+等,加热促进水解,过滤得到沉淀TiO2,加入过氧化氢和氨水反应得到(NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15,加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤液D加入过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4。
(1)化合物Li2Ti5O15中钛元素的化合价是+4价,Li元素的化合价为+1价,根据正负化合价的代数和为0,氧元素的化合价为-2、-1,故答案为:-2、-1;
(2)钛铁矿与硫酸反应时,常将钛铁矿粉碎,可以增大接触面积加快反应速率,提高浸出率,由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,故答案为:增大接触面积加快反应速率,提高浸出率;SiO2 、CaSO4;
(3) 二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15的离子方程式为5TiO2+4H2O2+2NH3·H2O=2NH4++Ti5O152-+5H2O,反应中没有元素的化合价发生变化,不属于氧化还原反应,故答案为:5TiO2+4H2O2+2NH3·H2O=2NH4++Ti5O152-+5H2O;不属于;
(4)由于二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
(5) (NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15,反应的离子方程式为Ti5O152-+2Li+=Li2Ti5O15↓,故答案为:Ti5O152-+2Li+=Li2Ti5O15↓;
(6)过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,反应离子方程式为:2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+,故答案为:2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+;
(7)根据电子守恒,过氧化氢氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,则:
H2O2~H2C2O4
34 90
x×17% y
所以![]() =
=![]() ,整理可得x:y=20:9,17%双氧水与H2C2O4的质量比为20:9,故答案为:20:9。
,整理可得x:y=20:9,17%双氧水与H2C2O4的质量比为20:9,故答案为:20:9。


科目:高中化学 来源: 题型:
【题目】请根据下列化合物的结构式分析回答:

(1)图中⑨名称是________,①名称是________。图中代表肽键的序号为____。
(2)该化合物是由_____个氨基酸分子失去_____水分子而形成的。
(3)该化合物叫_______肽。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y元素最高正价与负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物( )
A.KClB.Na2SC.Na2OD.K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别将下列物质:①FeCl3 ②KMnO4 ③NaCl ④Ca(HCO3)2 ⑤Na2SO3 ⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干灼烧,能得到原物质的是( )
A. ②③ B. ③⑥ C. ①④ D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。![]() 固定装置已略去
固定装置已略去![]()
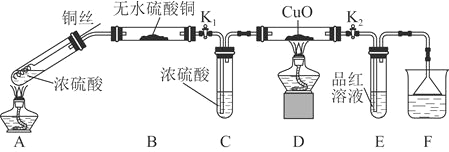
(1)A中反应的化学方程式为____________。
(2)F烧杯中的溶液通常是________________。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是______。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为_______。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
硫酸(mol/L) | 黑色物质出现的温度(℃) | 黑色物质消失的温度(℃) |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是_________。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用bmol/LNa2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为________。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
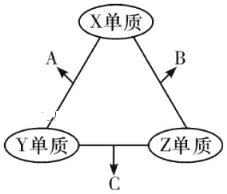
A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性
C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物X( )是一种香料,常用于肥皂、洗涤剂、化妆品中,其合成路线如图所示:其中A是相对分子质量为92的芳香烃。
)是一种香料,常用于肥皂、洗涤剂、化妆品中,其合成路线如图所示:其中A是相对分子质量为92的芳香烃。

已知Ⅰ.两个羟基连在同一个碳原子上会自动脱水生成羰基:
Ⅱ.D的核磁共振氢谱只有1组峰:
Ⅲ.
Ⅳ.R1CHO+R2CH2CHO![]()
 (R1、R2为烃基)
(R1、R2为烃基)
回答下列问题:
(1)B的结构简式为:___________,E的名称为:___________。
(2)X的分子式为:___________。
(3)C中官能团的名称为:___________,D→E的反应类型为:___________。
(4)F→G的化学反应方程式为:___________。
(5)H→X的化学反应方程式为:___________。
(6)满足下列条件的M(C10H12O)的结构有___________种(不考虑立体异构),其中核磁共振氢谱为5组峰的结构简式为:___________。①与F互为同系物②苯环上只有2个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)研究SO2的性质对改善空气质量具有重要意义。某化学兴趣小组为探究SO2的化学性质进行以下实验,如下图装置(加热及固定装置已略去)。

①以上实验中,体现SO2具有氧化性的实验现象为____________,对应化学方程式为_____________________。
② D装置的作用是__________,写出该装置中发生的离子方程式______________。
③ A中反应开始后,试管B中始终无明显现象。现将试管B中溶液分成两份,分别滴加一定量的氯水和氨水,均出现白色沉淀,任选其中一个实验,结合离子方程式进行解释:_____________________________________________。
(2)硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
① “钠碱法”用NaOH溶液作吸收剂,向 100 mL 0.3 mol·L-1的NaOH溶液中通入标准状况下0.448 L SO2气体,所得溶液中的溶质是_________________________________(填化学式)。
② 某硫酸厂拟用含Cr2O72的酸性废水处理烟气中SO2,反应后的铬元素以Cr3+形式存在,则反应中氧化剂和还原剂的物质的量之比是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要的医药中间体,其制备流程如下图所示。

已知: 。
。
回答下列问题:
(1)![]() 的名称为___________,其分子中共面原子数目最少为______________。
的名称为___________,其分子中共面原子数目最少为______________。
(2)![]() 直接硝化也可以制得B,但上述流程却经由①②③三步反应制取B,其目的是__________________。
直接硝化也可以制得B,但上述流程却经由①②③三步反应制取B,其目的是__________________。
(3)反应⑥的主要目的是______________。上述流程中不属于取代反应的有______(填序号)。
(4)有机物C 中含氧官能团的名称为__________;写出反应⑧的化学方程式:____________________。
(5)符合下列条件的B 的同分异构体共有______种。
a.苯环上有两个取代基 b.既能发生银镜反应又能发生水解反应
(6)已知当苯环上有硝基时,再引入的其他基团主要进入它的间位。以苯为主要原料,其他无机原料自选,设计一个合成![]() 的合成路线:_______________________。示例:A
的合成路线:_______________________。示例:A![]() B……→目标产物。
B……→目标产物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com