
【题目】
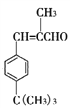
化合物X( )是一种香料,常用于肥皂、洗涤剂、化妆品中,其合成路线如图所示:其中A是相对分子质量为92的芳香烃。
)是一种香料,常用于肥皂、洗涤剂、化妆品中,其合成路线如图所示:其中A是相对分子质量为92的芳香烃。

已知Ⅰ.两个羟基连在同一个碳原子上会自动脱水生成羰基:
Ⅱ.D的核磁共振氢谱只有1组峰:
Ⅲ.
Ⅳ.R1CHO+R2CH2CHO![]()
 (R1、R2为烃基)
(R1、R2为烃基)
回答下列问题:
(1)B的结构简式为:___________,E的名称为:___________。
(2)X的分子式为:___________。
(3)C中官能团的名称为:___________,D→E的反应类型为:___________。
(4)F→G的化学反应方程式为:___________。
(5)H→X的化学反应方程式为:___________。
(6)满足下列条件的M(C10H12O)的结构有___________种(不考虑立体异构),其中核磁共振氢谱为5组峰的结构简式为:___________。①与F互为同系物②苯环上只有2个取代基
【答案】 ![]() 2-甲基丙烯 C14H20O 醛基 消去反应
2-甲基丙烯 C14H20O 醛基 消去反应  + CH3CH2CHO
+ CH3CH2CHO![]()
 +H2O
+H2O  +O2
+O2![]()
 +2H2O 15
+2H2O 15 
【解析】A是相对分子质量为92的芳香烃,结合B的分子式可知,则A的分子式为C7H8,A为甲苯(![]() ),与甲苯与氯气在光照条件下发生侧链的取代反应生成B,B为
),与甲苯与氯气在光照条件下发生侧链的取代反应生成B,B为 ,由于两个羟基连在同一个碳原子上会自动脱水生成羰基,因此C为
,由于两个羟基连在同一个碳原子上会自动脱水生成羰基,因此C为![]() ,D的核磁共振氢谱只有1组峰,则D为C(CH3)3Cl,D发生消去反应生成的E为(CH3)2C=CH2,结合F的分子式为C11H14O,C和E发生加成反应生成F,结合X(
,D的核磁共振氢谱只有1组峰,则D为C(CH3)3Cl,D发生消去反应生成的E为(CH3)2C=CH2,结合F的分子式为C11H14O,C和E发生加成反应生成F,结合X( )的结构和信息Ⅲ可知,F为
)的结构和信息Ⅲ可知,F为 ,根据信息Ⅳ可知,G为
,根据信息Ⅳ可知,G为 ,则H为
,则H为 。
。
(1)根据上述分析,B为![]() ,E为(CH3)2C=CH2,名称为2-甲基丙烯,故答案为:
,E为(CH3)2C=CH2,名称为2-甲基丙烯,故答案为:![]() ;2-甲基丙烯;
;2-甲基丙烯;
(2)根据X的结构简式,X的分子式为C14H20O,故答案为:C14H20O;
(3)C为![]() ,其中的官能团为醛基,根据D生成E的反应条件,D发生消去反应生成的E,故答案为:醛基;消去反应;
,其中的官能团为醛基,根据D生成E的反应条件,D发生消去反应生成的E,故答案为:醛基;消去反应;
(4)F( )→G(
)→G( )的化学反应方程式为
)的化学反应方程式为 +CH3CH2CHO
+CH3CH2CHO![]()
 +H2O,故答案为:
+H2O,故答案为: +CH3CH2CHO
+CH3CH2CHO![]()
 +H2O;
+H2O;
(5)H( )→X(
)→X( )的化学反应方程式为
)的化学反应方程式为 +O2
+O2![]()
 +2H2O,故答案为:
+2H2O,故答案为: +O2
+O2![]()
 +2H2O;
+2H2O;
(6) ①与F( )互为同系物,说明结构中含有苯环和醛基;②苯环上只有2个取代基,满足条件的M(C10H12O)的结构中含有—CHO和—C3H7、—CH2CHO和—C2H5、—C3H6O和—CH3,其中—C3H7有2种结构[—CH2CH2CH3和—CH(CH3)2],—C3H6O有2种结构[—CH2CH2CHO和—CH(CH3)CHO],即除苯环外,其余原子有5种组合,而每种组合有3种结构(邻位、间位和对位),共15种结构;其中核磁共振氢谱为5组峰的结构简式为
)互为同系物,说明结构中含有苯环和醛基;②苯环上只有2个取代基,满足条件的M(C10H12O)的结构中含有—CHO和—C3H7、—CH2CHO和—C2H5、—C3H6O和—CH3,其中—C3H7有2种结构[—CH2CH2CH3和—CH(CH3)2],—C3H6O有2种结构[—CH2CH2CHO和—CH(CH3)CHO],即除苯环外,其余原子有5种组合,而每种组合有3种结构(邻位、间位和对位),共15种结构;其中核磁共振氢谱为5组峰的结构简式为 ,故答案为:15;
,故答案为:15; 。
。


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】有两个无标签的试剂瓶,分别盛有Na2CO3、NaHCO3固体,有四位同学为鉴别它们采用了以下不同方法,其中可行的是( )
A.分别将它们配制成溶液,再加入澄清石灰水
B.分别将它们配制成溶液,再加入NaOH溶液
C.分别将它们配制成溶液,再进行焰色反应
D.分别加热,再用澄清石灰水检验是否有气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当航天飞机返回地球大气层时,由于与空气的剧烈摩擦,飞机尖端的温度可达1000℃以上,为了防止高温将其烧毁,科学家给航天飞机的相应部位安装了可靠的保护层。制作保护层的材料是
A.塑料B.玻璃
C.新型陶瓷D.镁铝合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:

(1)化合物Li2Ti5O15中钛元素的化合价是+4价,氧元素的化合价为__________。
(2)钛铁矿与硫酸反应时,常将钛铁矿粉碎,其目的是:__________,滤渣A的成分是__________。
(3)固体TiO2转化(NH4)2Ti5O15的离子方程式为__________,该反应__________氧化还原反应 (填“属于” 或“不属于” )。
(4)反应②中固体TiO2、转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降的原因是__________。

(5)(NH4)2Ti5O15转化为Li2Ti5O15的离子方程式为:__________。
(6)写出由滤液D生成FePO4的离子方程式__________。
(7)由滤液D制各LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A. 氯气通入水中,溶液呈酸性:Cl2 + H2O ![]() 2H+ + Cl+ClO
2H+ + Cl+ClO
B. AlCl3溶液中加入过量的浓氨水:Al3+ + 3NH3H2O = Al(OH)3 ↓ + 3NH4+
C. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
D. 向FeCl3溶液中加入铁粉:Fe3+ + Fe = 2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液态烃,0.1 mol该烃在足量的氧气中完全燃烧,生成0.6 mol CO2和0.3 molH2O;回答下列问题:
(1)A的电子式________,B的结构简式________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_______,反应类型:______________。
(3)在碘水中加入B物质的现象:________________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:__________,反应类型:______________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量__(填“A>B”、“A<B”或“A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 g·mL-1,质量分数36.5%的浓盐酸配制 0.1 mol·L-1的盐酸240 mL,请回答下列问题:
(1)浓盐酸的物质的量浓度为________。
(2)配制240 mL 0.1 mol·L-1的盐酸应选用________mL的容量瓶,需要浓盐酸体积为_____mL。
(3)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视刻度线,浓度 ____________ ;
②容量瓶未干燥,浓度 __________ ;
③定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度 ____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com