
【题目】银锌电池在商业、宇航潜艇、核武器等领域有广泛应用。一种从正极片(含Ag、Ag2O、石墨及Cu等)中回收银的流程如下,下列叙述错误的是
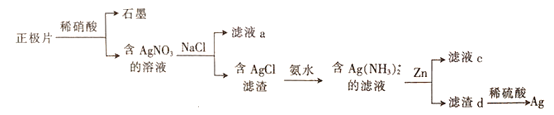
A. 滤液a中含有Na+、Cu2+、H+等阳离子
B. A用氨水溶解时发生的反应为AgCl+2NH3H2O=[Ag(NH3)2]++C1-+2H2O
C. 滤液c可浓缩结晶得到Zn(NO3)2
D. 向滤渣d中加稀硫酸可溶解其中过量的Zn
【答案】C
【解析】
正极片含Ag、Ag2O、石墨及Cu等加稀硝酸后,石墨不反应,含Ag、Ag2O、Cu和硝酸反应生成硝酸银,硝酸铜,再加氯化钠溶液会发生Ag++Cl—=AgCl![]() ,则滤液a中含有Na+、Cu2+、H+和Cl_、NO3-等离子;在含AgCl的滤渣中加入氨水会发反应生成Ag(NH3)2]C1和2H2O ,在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在, D.经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。
,则滤液a中含有Na+、Cu2+、H+和Cl_、NO3-等离子;在含AgCl的滤渣中加入氨水会发反应生成Ag(NH3)2]C1和2H2O ,在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在, D.经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。
A.正极片含Ag、Ag2O、石墨及Cu等加稀硝酸后,石墨不反应,含Ag、Ag2O、Cu和硝酸反应生成硝酸银,硝酸铜,再加氯化钠溶液会发生Ag++Cl—=AgCl![]() ,则滤液a中含有Na+、Cu2+、H+等阳离子,故A正确;B.在含AgCl的滤渣中加入氨水会发生应生成Ag(NH3)2]C1和2H2O ,即AgCl+2NH3H2O=[Ag(NH3)2]++C1-+2H2O,故B正确;C.在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在,故C错误;经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。故D正确;答案:C。
,则滤液a中含有Na+、Cu2+、H+等阳离子,故A正确;B.在含AgCl的滤渣中加入氨水会发生应生成Ag(NH3)2]C1和2H2O ,即AgCl+2NH3H2O=[Ag(NH3)2]++C1-+2H2O,故B正确;C.在银氨络合物中加入Zn反应后溶液中Zn2+与氨气结合以[Zn(NH3)4]2+,形式存在,故C错误;经过第一步过滤,知溶液c中不存在NO3-,滤渣d中过量的锌可以溶解于稀硫酸溶液中。故D正确;答案:C。


科目:高中化学 来源: 题型:
【题目】己知X、Y、Z都是金属,若把X浸入乙的盐溶液中,X的表面有乙析出;若X、Y和盐酸溶液形成原电池,Y为电池的负极。则X、Y、Z的金属活动顺序为
A. Y>X>Z B. X>Z>Y C. X>Y>Z D. Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.1 mol NH4 F中含有的质子数为2NA
B. 1LpH=12的Na2CO3溶液中含Na+的数目为0.01NA
C. 2.24L(标准状况)Cl2溶于水,生成H+的数目为0.1NA
D. 含6.08乙酸的水溶液中氧原子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常采用粗锌与稀硫酸制氢气,因此制氢废液中含有大量的硫酸锌,同时含少量硫酸亚铁、硫酸铅等杂质。由制氢废液制备硫酸锌晶体(ZnSO4·7H2O)的流程如下:

下列说法不正确的是
A. 步骤①,涉及的化学反应为:2Fe2++H2O2+2H+=2Fe3++2 H2O
B. 步骤②,加入适量ZnO的目的是:调节溶液pH,沉淀Fe3+
C. 步骤④,涉及的操作有:蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D. 步骤⑤,产物一定是:ZnO和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用镁还原硝基苯制取反式偶氮苯的化学方程式为:2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→![]() +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
③反式(顺式)偶氮苯橙红色晶体,溶于乙醇、乙醚和醋酸,不溶于水。遇明火、高热可燃,受高热分解放出有毒的气体。
主要实验装置和步骤如下:
(I)合成:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,加入少量镁粉,立即发生反应;等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
(II)分离与提纯:
①将所得液体趁热倒入烧杯的冰水中,并不断搅拌,用冰醋酸小心中和至pH为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
②用95%的乙醇重结晶。回答下列问题:
(1)如图加热回流装置中,仪器a的名称是________,进水口为________(填1或2)

(2)若将镁粉一次性加入已装硝基苯、甲醇混合液的三颈瓶中,可能导致_________________。
A.反应太剧烈 B.液体太多搅不动 C.反应变缓慢 D.副产物增多
(3)分离与提纯:

①析出橙红色固体,过滤,用少量冰水洗涤中用冰水洗涤的原因是________________。
②为了得到较大颗粒的晶体,加入冰醋酸时需要________(填“缓慢加入”、“快速加入”)。
③烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是_______。
A.冰水 B.饱和NaCl溶液
C.95%乙醇水溶液 D.滤液
④抽滤完毕,应先断开________________________,以防倒吸。
⑤重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的________操作除去了不溶性杂质。
(4)取0.1 g偶氮苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1 cm处,再将滤纸条末端浸入装有1∶3的苯环己烷溶液的容器中,实验操作及现象如下图所示:


①实验中分离物质所采用的方法是________法。
②薄层色谱分析中,极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图所示,则反式偶氮苯比顺式偶氮苯的分子极性________________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物如Fe(OH)2、K2FeO4等在生产、生活中有重要作用。
(1)某学生用下列两种方法(如图)制备白色沉淀Fe(OH)2。方法1中加入维生素C的目的是_________________________________;方法2为了制得Fe(OH)2白色沉淀,在锥形瓶A和锥形瓶B中加入试剂后,打开止水夹C一段时间,再关闭止水夹C,关闭止水夹C的目的是_____________________________________________。

(2)实验室用氧化锌矿粉(主要成分为2ZnO、FeCO3)制备碱式碳酸锌[Zn(OH)2CO3],矿粉经“稀H2SO4溶解、H2O2氧化、调节pH"三步将矿粉中的Fe元素转化为沉淀而除去
不能用稀HNO3代替稀H2SO4溶解的理由是_______________________________。
(3)高铁酸钾(K2FeO4)是一种高效水处理剂,易溶于水,在强碱性条件下比较稳定,通常可用NaClO溶液与Fe(NO3)3溶液反应制得

①制备Na2 FeO4的化学方程式为________________________。
②能析出K2FeO4的原因是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答下列问题:


(1)写出三个装置中发生反应的主要化学方程式:________________。写出B中右边试管中所发生反应的化学方程式:__________________。
(2)装置A和C均采用了长玻璃导管,其作用是_______、____________。
(3)在实验B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是________________;应对装置C进行的操作是_______________________。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是_________________。
(5)B中采用了洗气瓶吸收装置,其作用是______________________,反应后洗气瓶中可能出现的现象是_______________。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_____________________;_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中数据合理的是
A.用10 mL 量筒量取5.2 mL盐酸
B.用广泛pH试纸测得某溶液的pH值为12.5
C.用托盘天平称取25.12gNaCl固体
D.用100 mL容量瓶配制50mL0.1 mol/L的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com