
【题目】己知X、Y、Z都是金属,若把X浸入乙的盐溶液中,X的表面有乙析出;若X、Y和盐酸溶液形成原电池,Y为电池的负极。则X、Y、Z的金属活动顺序为
A. Y>X>Z B. X>Z>Y C. X>Y>Z D. Y>Z>X
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某气态烃中碳和氢的质量比是24∶5,该烃在标准状况下的密度为2.59 g·L-1,其分子式为 ( )
A. C2H6B. C4H10C. C4H8D. C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:下列说法正确的是( )
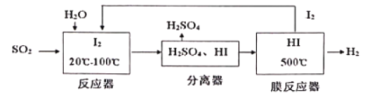
A. 分离器中的物质分离操作为过滤
B. 该工艺中HI的量没有改变,可视作该工艺的催化剂
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)设NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 1 mol甲苯含碳碳双键的数目为3NA
B. 56 g纯铁粉与稀硝酸反应生成NO的分子数为NA
C. 25 ℃,1 L pH=13的氢氧化钡溶液中含OH-的数目为0.2NA
D. 标准状况下,11.2 L一氯甲烷含共价键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
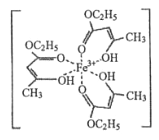
①此配合物中,基态铁离子的价电子排布式为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A. 离子键 B. 金属键 C. 极性键 D. 非极性键 E. 配位键 F. 氢键 G.σ键 H. π键
④氯化铁在常温下是固体,熔点为 306℃,沸点为 315℃,在 300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氯化铁的晶体类型为________________。
(2)基态 A 原子的价电子排布式为 3s23p5,铜与A 形成化合物的晶胞如图所示(黑球代表铜原子)。
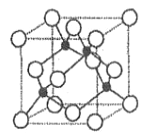
①该化合物的化学式为________________,A原子的配位数是______________。
②该化合物难溶于水,但易溶于氨水,其原因可能是________________;与NH3 互为等电子体的分子有________________(写化学式,一种即可)。 NH3 的键角大于H2O的键角的主要原因是_______________________。
③已知该化合物晶体的密度为ρg·cm-3,阿伏加德罗常数的值为 NA,则该晶体中 Cu 原子和A 原子之间的最短距离为________________pm(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在周期表中的位置如下图所示,其中B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C是
A | ||
B | C |
A. B、Mg、Si B. Be、Na、Al C. O、P、Cl D. C、Al、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明溶液中是否有Fe2+,其操作正确的顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A. ①②B. ②③C. ③②D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池在商业、宇航潜艇、核武器等领域有广泛应用。一种从正极片(含Ag、Ag2O、石墨及Cu等)中回收银的流程如下,下列叙述错误的是
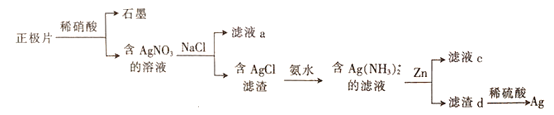
A. 滤液a中含有Na+、Cu2+、H+等阳离子
B. A用氨水溶解时发生的反应为AgCl+2NH3H2O=[Ag(NH3)2]++C1-+2H2O
C. 滤液c可浓缩结晶得到Zn(NO3)2
D. 向滤渣d中加稀硫酸可溶解其中过量的Zn
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com