
【题目】证明溶液中是否有Fe2+,其操作正确的顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A. ①②B. ②③C. ③②D. ①②③
科目:高中化学 来源: 题型:
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、MgO少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
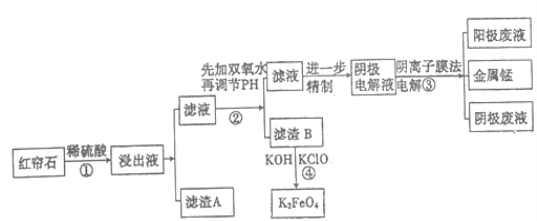
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________________________________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_________________________。
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________ L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 在水玻璃溶液中通入少量CO2:SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-
B. 向0.1L5mol·L-1亚硫酸氢铵溶液中逐滴加入0.1L7mol·L-1 NaOH溶液:2NH![]() +5HSO3-+7OH-===2NH3·H2O+5SO
+5HSO3-+7OH-===2NH3·H2O+5SO![]() +5H2O
+5H2O
C. Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
D. 向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=AlO2-+2H2O+4NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知X、Y、Z都是金属,若把X浸入乙的盐溶液中,X的表面有乙析出;若X、Y和盐酸溶液形成原电池,Y为电池的负极。则X、Y、Z的金属活动顺序为
A. Y>X>Z B. X>Z>Y C. X>Y>Z D. Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.1 mol NH4 F中含有的质子数为2NA
B. 1LpH=12的Na2CO3溶液中含Na+的数目为0.01NA
C. 2.24L(标准状况)Cl2溶于水,生成H+的数目为0.1NA
D. 含6.08乙酸的水溶液中氧原子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常采用粗锌与稀硫酸制氢气,因此制氢废液中含有大量的硫酸锌,同时含少量硫酸亚铁、硫酸铅等杂质。由制氢废液制备硫酸锌晶体(ZnSO4·7H2O)的流程如下:

下列说法不正确的是
A. 步骤①,涉及的化学反应为:2Fe2++H2O2+2H+=2Fe3++2 H2O
B. 步骤②,加入适量ZnO的目的是:调节溶液pH,沉淀Fe3+
C. 步骤④,涉及的操作有:蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D. 步骤⑤,产物一定是:ZnO和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物如Fe(OH)2、K2FeO4等在生产、生活中有重要作用。
(1)某学生用下列两种方法(如图)制备白色沉淀Fe(OH)2。方法1中加入维生素C的目的是_________________________________;方法2为了制得Fe(OH)2白色沉淀,在锥形瓶A和锥形瓶B中加入试剂后,打开止水夹C一段时间,再关闭止水夹C,关闭止水夹C的目的是_____________________________________________。

(2)实验室用氧化锌矿粉(主要成分为2ZnO、FeCO3)制备碱式碳酸锌[Zn(OH)2CO3],矿粉经“稀H2SO4溶解、H2O2氧化、调节pH"三步将矿粉中的Fe元素转化为沉淀而除去
不能用稀HNO3代替稀H2SO4溶解的理由是_______________________________。
(3)高铁酸钾(K2FeO4)是一种高效水处理剂,易溶于水,在强碱性条件下比较稳定,通常可用NaClO溶液与Fe(NO3)3溶液反应制得

①制备Na2 FeO4的化学方程式为________________________。
②能析出K2FeO4的原因是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案,方案一如下图所示,方案二如下图所示。请回答下列问题(本题不考虑N2O4存在产生的影响):

(1) 浓硝酸受热分解的化学方程式是______________。
(2) 方案一实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是_________________________________。
(3) 硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是_____________。
(4) 方案二实验当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是____________ 。
(5) 为了更直接地说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作:____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com